что молекулярные силы являются короткодействующими —молекулы взаимодействуют только со своими ближайшими соседями. Если изобразить молекулы в виде плотно упакованных шариков (рис. 3), что в общем соответствует упаковке молекул во многих жидкостях и твердых газах, то зачерненная молекула взаимодействует только с первым окружающим ее слоем. С погрешностью, не превосходящей 3%, можно пренебречь взаимодействием молекулы со вторым, а тем более с третьим и далее лежащими слоями.
Этим и объясняются все особенности молекулярных сил, рассмотренные выше, в частности независимость величины молекулярных сил от общего числа молекул в системе и отсутствие молекулярного взаимодействия в газах (кроме случая очень больших давлений).
Потенциальная кривая молекулярного взаимодействия.
 Зная характер молекулярных сил, можно построить
график: энергии молекулярного взаимодействия — так называемую потенциальную
кривую.
Зная характер молекулярных сил, можно построить
график: энергии молекулярного взаимодействия — так называемую потенциальную
кривую.
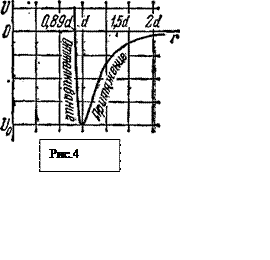
Прежде всего, потенциальная кривая при r<d должна быть наклонена к оси абсцисс под тупым углом, ибо здесь, действует положительная сила отталкивания. Из этих же соображений потенциальная кривая должна быть наклонена к абсцисс под острым углом, ибо здесь действует сила притяжения. А отсюда следует, что при r=~ dкривая имеет минимум.
Этим подтверждается высказанное положение, что в состоянии равновесия система молекул обладает минимальной энергией.
Поскольку сила отталкивания меняется с расстоянием значительно сильнее силы притяжения, то потенциальная кривая оказывается несимметричной Левее точки минимума, при r<d, она спадает очень круто. Правее точки минимума, при r>d, она вначале возрастает, но по более пологой кривой, а затем ее рост вообще прекращается, ибо при r>>d сила взаимодействия практически равна нулю.
Как известно, нулевой, уровень потенциальной энергии может быть выбран произвольно. Удобно положить, что потенциальная энергия равна нулю при бесконечном удалении молекул друга от друга. Тогда практически; она станет равна нулю уже три r> 2d.
Потенциальная кривая межмолекулярного взаимодействия изображена рис. 4. Здесь. U-— минимальная энергия взаимодействия между молекулами, которой они бы обладали, если бы находились друг от друга на расстоянии d и покоились. Анализ этой кривой позволяет судить о многих свойствах твердых тел и жидкостей.
Тепловое расширение твердых тел и жидкостей
1. Опыт показывает, что при повышении температуры объем твердых тел и жидкостей возрастает. Выясним причину теплового расширения. При этом следует учесть, что хотя структура и свойства твердых тел и жидкостей различны, для механизма теплового расширения эти различия роли не играют.
 В твердом теле или жидкости при
заданной температуре молекулы находятся друг от друга на определенных
расстояниях и совершают колебания около положений равновесия. Изобразим на
потенциальной кривой значения полной энергии молекулы для ряда значений
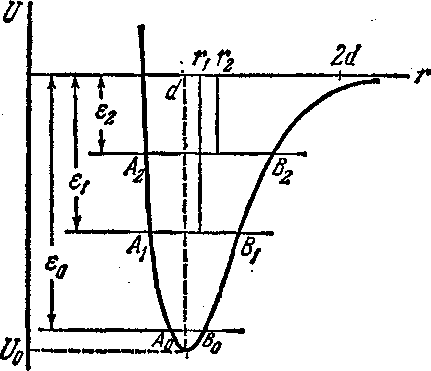
температуры тела (рис. 5). Здесь ε0
— так называемая нулевая энергия —
минимальная энергия колебаний молекулы при абсолютном нуле температуры; ε1 и ε2 — энергии
колебания молекулы при температурах Τ1и T2 Из рис. 5
видно, что при абсолютном нуле молекулы колеблются около положений равновесия,
расстояние между молекулами равно d.
В твердом теле или жидкости при
заданной температуре молекулы находятся друг от друга на определенных
расстояниях и совершают колебания около положений равновесия. Изобразим на
потенциальной кривой значения полной энергии молекулы для ряда значений
температуры тела (рис. 5). Здесь ε0
— так называемая нулевая энергия —
минимальная энергия колебаний молекулы при абсолютном нуле температуры; ε1 и ε2 — энергии
колебания молекулы при температурах Τ1и T2 Из рис. 5
видно, что при абсолютном нуле молекулы колеблются около положений равновесия,
расстояние между молекулами равно d.
При повышении температуры тела энергия колебаний возрастает. Следовательно, если при температуре T1 молекула колеблется между точками A1и B2то при температуре Т2 она станет колебаться между точками A2 и В2. А так как потенциальная кривая имеет несимметричную форму, то точка В смещается вправо значительно сильнее, чем точка А влево. Отсюда следует, что положение равновесия при повышении температуры тоже смещается вправо. Иными словами, расстояние между молекулами при повышении температуры увеличивается за счет несимметричной формы потенциальной кривой молекулярного взаимодействия.
Обратимся к результатам эксперимента. Оказывается, что в небольшом интервале температур вдали от абсолютного нуля относительное изменение объема пропорционально изменению температуры:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.