
Министерство образования Российской Федерации
Санкт-Петербургский государственный горный институт им. Г.В. Плеханова
(технический университет)

(наименование учебной дисциплины согласно учебному плану)
Выполнил: студент гр. АПМ-03 ______________ /Зятьков Р.Э./
(подпись) (Ф.И.О.)
(подпись) (Ф.И.О.)
Санкт-Петербург
2004 год
Цель работы: 1.определить среднеионный коэффициент активности электролита в растворе
2. потенциометрическое титрование компенсационным методом.
Сущность работы: определить ЭДС электролита и стандартный электродный потенциал электрода первого рода. Стандартный электродный потенциал вычисляют по уравнению Нернста Определить концентрацию ионов I- и Cl-, основываясь на образовании труднорастворимого соединения (AgI и AgCl) с различными значениями произведения растворимости. Вследствие протекания реакции потенциал серебряного электрода постепенно повышается в соответствии с уравнением. Как только все ионы I- окажутся связаны в AgI наступит резкий скачок потенциала из-за исчезновения ионов I-. Оставшиеся в растворе ионы Cl- взаимодействуют с раствором AgNO3 до образования осадка AgCl, наблюдается резкий скачок потенциала. Электродом сравнения служит хлорсеребряный электрод.
Приборы и реактивы: потенциометр, электроды: медный, цинковый, свинцовый, хлорсеребряный электрод сравнения, химический стакан 50 мл, электролитический мост, сульфат никеля 0,5 н раствор, сульфат меди 0,5 н, нитрат свинца 0,5 н, хлорид калия насыщенный раствор, наждачная бумага;
Потенциометр, бюретка, пипетка 10 мл, стакан 200 мл, электролитический ключ, серебряный электрод, хлорсеребряный электрод, раствор AgNO3 0,05 н, хлорид калия насыщенный раствор.
Ход работы:
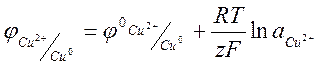
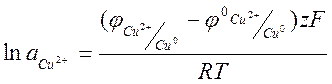
![]()
![]()
4. ![]()
![]()
![]()
![]() , где m- моляльность раствора,
, где m- моляльность раствора, ![]() -
средняя ионная моляльность,
-
средняя ионная моляльность, ![]() .
.
![]()
![]()
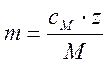
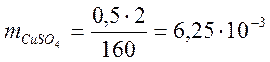 М
М 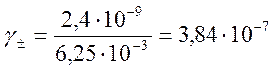
В сосуд емкостью 200 мл внесли пипеткой 10 мл испытываемого раствора. Собрали схему
![]() .
Хлорсеребряный электрод подключают к клейме «+» потенциометра, платиновый к
«-». Растворы соединяют электролитическим мостиком.
.
Хлорсеребряный электрод подключают к клейме «+» потенциометра, платиновый к
«-». Растворы соединяют электролитическим мостиком.
Титруем раствор и измеряем ЭДС электрода после добавления каждого 1 мл титранта, до резкого изменения потенциала.
Результаты титрования:
|
№ |
E, мВ |
VAgNO3 , мл |
|
|
0 |
172 |
0 |
|
|
1 |
166 |
1 |
6 |
|
2 |
164 |
2 |
2 |
|
3 |
160 |
3 |
4 |
|
4 |
155 |
4 |
5 |
|
5 |
150 |
5 |
5 |
|
6 |
140 |
5,5 |
20 |
|
7 |
130 |
6 |
20 |
|
8 |
124 |
6,5 |
12 |
|
9 |
120 |
7 |
8 |
По графику зависимости найдем точку эквивалентности при VT=5,5 мл.
Концентрация рассчитывается по формуле 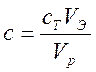 , где Vэ-
объем титрата, мл; cT – концентрация титрата; Vp- объем пробы, мл.
, где Vэ-
объем титрата, мл; cT – концентрация титрата; Vp- объем пробы, мл.
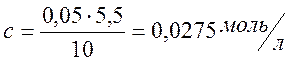 .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.