Лабораторная работа 20
ИЗУЧЕНИЕ ИЗОПРОЦЕССОВ В ГАЗАХ
(с компьютерным интерфейсом)
Цель работы – экспериментально изучить справедливость закона Бойля-Мариотта при постоянной массе газа (воздуха), из полученного соотношения рассчитать универсальную газовую постоянную.
Общие сведения
Идеальным газом называется газ, обладающий следующими свойствами:
1) Размеры молекул малы по сравнению с расстояниями между ними, т.е. молекулы считаются материальными точками.
2) Между молекулами нет сил взаимодействия за исключением лишь моментов столкновений. При столкновениях молекулы ведут себя как абсолютно упругие шарики.
Реальные газы при малых плотностях (малых давлениях) и при не очень высоких и не слишком низких температурах подчиняются законам идеальных газов.
Термодинамической системой называется совокупность тел, которые взаимодействуют и обмениваются энергией, как между собой, так и с другими телами (внешней средой). Отдельное тело или газ, находящийся в сосуде, также можно рассматривать как термодинамическую систему.
Совокупность значений некоторого числа физических величин, характеризующих физические свойства тела (системы тел), определяют термодинамическое состояние тела (системы тел). Подобные величины, характеризующие состояние системы и изменяющиеся под влиянием внешних воздействий, называются параметрами состояния.
Переход системы из одного состояния в другое называется процессом.
Состояние данной массы газа М полностью определяется тремя параметрами: давлением p, объемом V и температурой Т. Эти параметры закономерно связаны друг с другом, так что изменение одного из них влечет за собой изменение других. Соотношение, дающее связь между параметрами системы, называется уравнением состояния данной системы.
Для идеального газа уравнением состояния является уравнение Менделеева-Клапейрона:
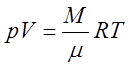 . (1)
. (1)
R-универсальная газовая постоянная.
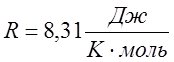 ( в СИ.)
( в СИ.)
m - молярная масса.
Из уравнения Менделеева-Клапейрона можно легко получить уравнения различных процессов в газах.
Изопроцессами называются процессы, протекающие в системе с неизменной массой при постоянном значении одного из параметров системы.
1) Изотермическим называется процесс, протекающий при неизменной температуре (М=const, T=const)
Записав уравнение Менделеева-Клапейрона для двух состояний
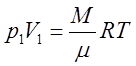 ,
, 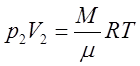 ,
,
получим
![]() или
или ![]() (2)
(2)
Это уравнение изотермического процесса (закон Бойля - Мариотта).
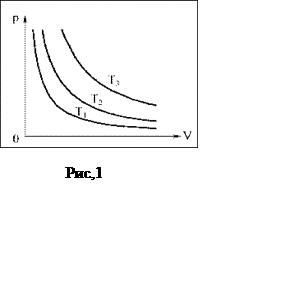 Математически это уравнение
выражает обратно пропорциональную зависимость давления от объема. На графике
зависимости p от V
изотермический процесс изображается кривой, называемой изотермой. На
рис.1 представлены изотермы для трех различных температур (Т1< Т2
<Т3).
Математически это уравнение
выражает обратно пропорциональную зависимость давления от объема. На графике
зависимости p от V
изотермический процесс изображается кривой, называемой изотермой. На
рис.1 представлены изотермы для трех различных температур (Т1< Т2
<Т3).
2) Изобарным называется процесс, протекающий при неизменном давлении (M=const, р=const)
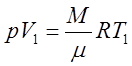 ,
, 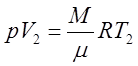
Отсюда
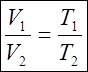 или
или 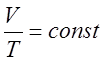 (3)
(3)
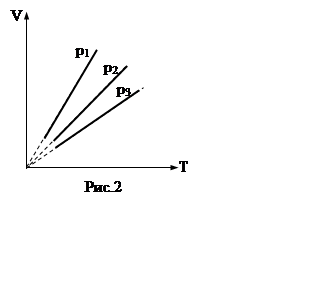 Это уравнение изобарного процесса
(закон Гей – Люссака). Оно выражает прямо пропорциональную зависимость объема
от температуры. На графике зависимости V от T изобарный процесс изображается прямой проходящей через
начало координат. На рис.2 представлены графики изобарного процесса для трех
различных значений давления (p1<
p2 <p3).
Прямые не могут быть продолжены в область низких температур, где законы
идеальных газов неприменимы.
Это уравнение изобарного процесса
(закон Гей – Люссака). Оно выражает прямо пропорциональную зависимость объема
от температуры. На графике зависимости V от T изобарный процесс изображается прямой проходящей через
начало координат. На рис.2 представлены графики изобарного процесса для трех
различных значений давления (p1<
p2 <p3).
Прямые не могут быть продолжены в область низких температур, где законы
идеальных газов неприменимы.
3) Изохорным называется процесс, протекающий при неизменном объеме
(M=const, V=const)
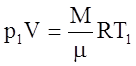 ,
, 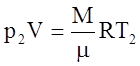 ,
,
Отсюда
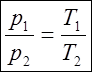 или
или 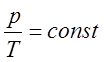 (4)
(4)
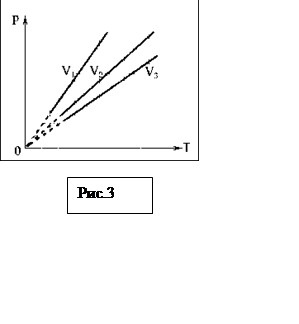 Это уравнение изохорного процесса
(закон Шарля). Оно выражает прямо пропорциональную зависимость давления от
температуры. На графике зависимости р от T изохорный
процесс изображается прямой проходящей через начало координат. На рис.3
представлены графики изохорного процесса для трех различных значений
объема (V1< V2 <V3).
Прямые не могут быть продолжены в область низких температур, где законы
идеальных газов неприменимы.
Это уравнение изохорного процесса
(закон Шарля). Оно выражает прямо пропорциональную зависимость давления от
температуры. На графике зависимости р от T изохорный
процесс изображается прямой проходящей через начало координат. На рис.3
представлены графики изохорного процесса для трех различных значений
объема (V1< V2 <V3).
Прямые не могут быть продолжены в область низких температур, где законы
идеальных газов неприменимы.
Вид экспериментальной установки представлен на рис.4

Основной деталью установки является шприц (1) с плунжером (поршнем) (2). Выходное отверстие шприца через уплотняющую трубку герметично соединяется с датчиком давления (4) при изучении законов Бойля –Мариотта и Шарля или с датчиком температуры (5) при изучении закона Гей –Люссака. При перемещении плунжера меняется объем воздуха в шприце и соответственно меняется давление. Для предотвращения утечки воздуха плунжер смазан машинным маслом. Датчики давления и температуры подсоединены к универсальной измерительной установке Кобра3 (6),которая в свою очередь при помощи информационного кабеля подсоединена к компьютеру.
Шприц находится в стеклянном кожухе (7), в который заливается вода. С помощью нагревателя (8) воду можно нагревать, а, следовательно, и менять температуру воздуха в шприце. В правое верхнее отверстие кожуха вставлена термопара (9) , которая также подсоединена к измерительной установке. Внутрь кожуха с водой помещена магнитная мешалка, которую с помощью магнита (10) можно перемещать и тем самым перемешивать нагреваемую воду для равномерного распределения температуры.
(при изучении закона Бойля –Мариотта)
Включите компьютер и измерительную установку Кобра3.
Запустите программу «measure», выберите в меню «Приборы» команду «Кобра3. Идеальный газ». На экране монитора появится окно для установки необходимых параметров (рис.5).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.