В проявлении биологических функций пептидов и белков очень важно их пространственное строение. Оно в значительной мере определяется электронным строением пептидной группы.
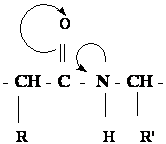
p, π - сопряжение в пептидной группе приводит к частичной двоесвязанности С-Nсвязи, что затрудняет вращение вокруг этой связи

Такая частичная двоесвязанность C-N связи означает, что пептидная группа представляет собой плоский участок пептидной цепи, рядом с которым находятся атомы С своеобразные шарниры где возможно вращение вокруг связей С - С и N - C
Т.О. кроме первичной структуры полипептидной цепи существует
более высокий уровень ее структурной организации - вторичная
структура: пространственное расположение цепи (конформация), фиксируемое водородными связями. Отдельные участки цепи образуют α-спираль, что впервые было показано Полингом.
В одном витке спирали умещаются
3,6 аминокислотных остатка, т.е. каждая аминокислота связывается с 5-ой по счету в первичной последовательности. Например, в последовательности Гли - Ала - Фен - Глу - Сер - Ала остаток глицина образует водородную связь с остатком серина
Кроме водородных связей могут быть и другие виды взаимодействий, приводящие к стабилизации цепи в пространстве: ионные взаимодействия между заряженными группами СОО и NН2 ковалентные связи S - S за счет окисления групп SH остатков цистеина.
16.2 Установление первичной структуры пептидов
Первичная структура пептидов и белков определяется путем последовательного отщепления α-аминокислот с какого-либо конца макромолекулярной цепи и их идентификации.
В настоящее время разработано много методов определения аминокислотной последовательности. Остановимся на некоторых из них :
1) Метод Сенгера - один из первых методов с 2,4-динитрофторбензолом (ДНФБ)
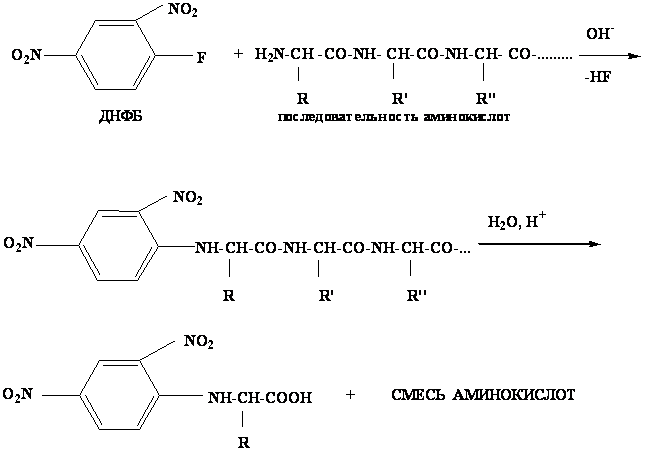
2) Метод Эдмана с фенилизотиоцианатом (ФТГ)
Преимуществом этого метода является то, что при отщеплении каждой N-концевой α-аминокислоты, остальная часть пептидной молекулы не разрушается. Такие же операции можно повторять дальше до полного определения первичной структуры и этот метод получил название деградации по Эдману (1950 год)

Метод Эдмана лежит в основе автоматического прибора - секвенатора (sequence от английского - последовательность). Полученное на каждой стадии производное идентифицируется либо ГЖХ либо ТСХ или жидкостной хроматографией.
16.3 Стратегия пептидного синтеза.
Схематично рассмотрим синтез дипептида ГЛИ –ЛЕЙ.
Для осуществления синтеза пептида с заданной последовательностью α-аминокислот необходимо выполнить ряд последовательных операций.
Первый этап синтеза - защита амино группы одной аминокислоты. С помощью реакций ацилирования в аминогруппу вводят электроноакцепторный заместитель. По окончанию синтеза эту защиту снимают.
В качестве реагентов для защиты чаще всего используют карбоксибензилхлорид С6Н5СН2ОСОСl или трет-бутоксикарбонилхлорид – (СН3)3СОСОСl
![]() H3C
H3C
Н3С – С – О – СOCl + НООС – СН2 – NH2 → HOOC-CH2-NH-CO-O-C(CH3)3
![]() H3C
H3C
БОК-защита
Это защищенное соединение обычно записывают таким образом
БОК – NH – CH2 – COOH
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.