Кислотные аккумуляторные батареи в настоящие время полностью заменили щелочные. О достоинствах щелочных аккумуляторов достаточно хорошо сказано в книги Майорова В. Н. «Устройство и ремонт электрооборудования вагонов». Авторы данной брошюры ставят перед собой задачу выяснить: «Почему в последнее время, примерно с конца 80 – х начала 90 – х годов, щелочные аккумуляторные батареи пассажирских вагонов не соответствуют своим техническим характеристикам, не выдают до 50% своей ёмкости, быстро разряжаются?» Это относится к новым аккумуляторам новых вагонов постройки ТВЗ, вагонов, прошедших плановые виды ремонта с заменой аккумуляторных батарей.
Заводы – изготовители аккумуляторов в инструкции по эксплуатации рекомендует: «Сообщите аккумуляторам два прогоночных и один контрольный цикл» - пункт 6.8.6. для аккумуляторов КМ – 300.
«Сообщить два тренировочных цикла» - пункт 6.4. для аккумулятора KL – 250Р.
В данном случае надо не рекомендовать, а обязать сделать формование, без которого нельзя эксплуатировать щелочные аккумуляторы.
Процесс формовки аккумулятора требует большого расхода электроэнергии и трудовых затрат. Экономия на данном этапе подготовки аккумулятора не только не выгодна экономически – больше электроэнергии и трудовых затрат потратится на дозорядке при эксплуатации негодной аккумуляторной батареи, но и недопустимо по безопасности движения. При зарядке в пути следования от генератора может выделиться большое количество взрывоопасных (гремучих) газов.
Аккумуляторщики обязаны хорошо знать: устройство аккумуляторов. Какие химические реакции проходят при малых нагрузках?
Почему после глубокого разряда аккумулятор необходимо вновь формовать?
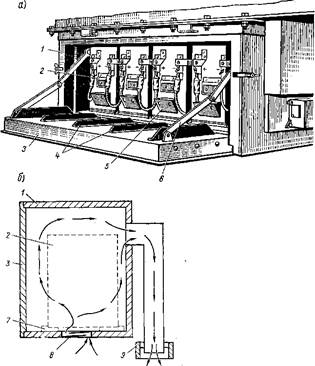
Подвагонный аккумуляторный ящик: а — общий вид; б — схема его вентиляции
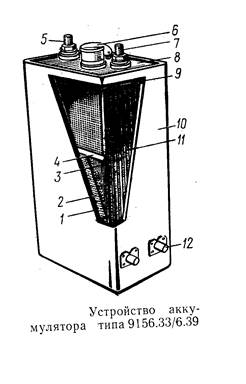
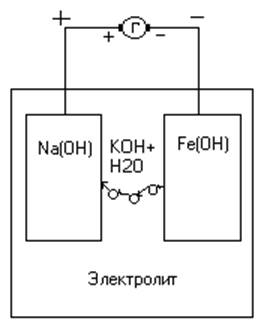
Щелочной аккумулятор состоит из прямоугольного бака (стальной оксидированный, стальной с полимерным покрытием или пластмассовый) в который помещён блок положительных и блок отрицательных пластин – электродов, изолированных друг от друга сепараторами. Пластины ломельного типа представляют собой коробочки, изготовленные из стальной никелированной ленточки. Коробочки наполнены активной массой и имеют большое количество отверстий размером 0,25 * 0,35мм, для доступа электролита к активной массе. Малые размеры отверстий препятствуют обильному выпадению активной массы.
Активная масса отрицательных пластин – железо или кадмий с примесью окислов железа.
Активная масса положительных пластин – гидрат окиси или закиси никеля.
Электролит – гидрат окиси калия или натрия плотностью 1,22 – 1,24 г/см3 с добавкой гидроокиси лития 20 г/л.
При заряде аккумулятора под действием электрической энергии, подводимой от внешнего источника гидрат закиси никеля Ni(OH)2 превращается в гидрат окиси Ni(OH)3, а активная масса отрицательных пластин из гидрата закиси железа Fe(OH)2 восстанавливается с образованием железа:
2Ni(OH)2+2KOH+Fe(OH)2=2Ni(OH)3+2KOH+Fe
В электролитах носителями зарядов являются ионы, части молекул имеющие положительный или отрицательный заряд.
Приведённое выше уравнение химической реакции при заряде щелочного аккумулятора имеет общий вид. Правильно следует рассматривать как сумму минимум двух уравнений:
2Ni(OH)2+2KOH=2Ni(OH)3+2K+
2K++Fe(OH)2=2KOH+Fe+
Щёлочь в электролите сначала разделяется на положительно заряженную частицу К+ и отрицательно заряженную (OH)-. Движение частицы (OH)- в электролите от одного электрода через щёлочь к другому электроду вызывает диффузию (перемешивание электролита) видимую невооружённым взглядом. Это происходит потому, что масса частицы (OH)- практически равна массе молекулы воды (H2O) в щёлочи. Во второй стадии реакции щёлочь KOH восстанавливается. Рассмотренная нами реакция происходит во время заряда щелочного аккумулятора малыми токами. Из уравнения видно, что никаких газов практически не выделяется, электролит не расходуется, тепло практически не выделяется.
При заряде глубоко разряженных аккумуляторов повышенным напряжением можно наблюдать «кипение» электролита с выделением газов. Это «кипение» будет интенсивнее при повышение зарядного напряжения, а значит и зарядного тока. Для электролитов справедлив закон Ома.
 Нагрузочная вилка
Нагрузочная вилка  Ариометр
Ариометр
При режиме заряда малым током химическую реакцию можно было показать двумя уравнениями, а с повышением зарядного тока в электролите происходят более сложные процессы:
1) Ni(OH)2+KOH=Ni(OH)3+K+
Эта реакция осталась без изменений, но в связи с увеличением тока необходимо большее количество частиц (OH)-, значит, резко возрастает количество положительно заряженных частиц К+. Калий и Натрий, химически очень активные металлы, которые не могут существовать в природе в чистом виде. Моментально реагируя с водой, они образуют щёлочь. В электролите с избытком частиц К+ и наличием молекул воды происходит следующая реакция:
2) 2K++H2O=2KOH+H2↑+Q.
В результате этой реакции выделяется водород и большое количество тепла. При формовании аккумулятора необходимо следить за температурой, которая не должна превышать 450С.
3) Fe(OH)2=Fe+2(OH)-
Эту реакция записана в таком виде, чтобы было понятно, что на отрицательном электроде происходит тот же процесс восстановления железа, но отрицательно заряженные частицы уже не все найдут свою частицу К+, поэтому между ними происходит своя реакция:
4) 2(OH)-+2(OH)-=2H2O+O2↑
Отсюда делаем вывод: При заряде аккумулятора большими силами тока, или очень высоким напряжением идёт обильное выделение водорода и кислорода, смесь которых образует гремучий газ и выделяется тепло (греется аккумулятор).
Активная масса электродов и щёлочи в электролите не расходуется, расходуется вода из электролита за счёт выделения газов водорода и кислорода, и испарений при нагревании. Средний расход воды в сутки должен быть 1,5мм по уровню электролита при нормальных климатических и эксплуатационных условиях. Плотность электролита практически остаётся неизменной.
Для полного понимания происходящих внутри аккумулятора процессов в режиме заряда и разряда рассмотрим их на рисунке.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.