Рассчитать равновесие химической реакции
С2Н4 + С3Н6 → н-C5H10
в неидеальной системе.
IЭтап
Составить таблицу для термодинамических данных предоставленной химической реакции
|
Соединение |
∆fH0298 |
S0298 кал/моль*К |
∆fG0298 ккал/моль |
Cp ккал/моль |
a |
b*103 |
c*106 |
|
C2H4 |
12,496 |
52,45 |
16,282 |
10,41 |
1,003 |
36,948 |
-19,331 |
|
C3H6 |
4,879 |
63,8 |
14,99 |
15,27 |
0,79 |
56,372 |
-28,107 |
|
C5H10 |
-5 |
82,65 |
18,96 |
26,19 |
1,788 |
101,454 |
-55,427 |
II Этап
По закону Гесса рассчитать изменения энтальпии и энтропии реакции, а также разность коэффициентов ∆a, ∆b, ∆c.
∆rH0298 = ∑j’*H0298 - ∑j*H0298
∆rH0298 = -5 – 4.879 – 12.496 = -22.375 ккал
∆rS0298 = -33.6 кал/К
∆a = - 0.005
∆b = 8.134*10-3
∆c = -7.989*10-6
Ш Этап
По формуле Темкина - Шварцмана рассчитать изменение энергии Гиббса ∆G в интервале от 300 до 900 К с шагом 1000. Построить таблицу и график зависимости ∆G0Т = ∆rH0298 – Т(∆a*M0 + ∆b*M1 + ∆c*M2)
|
T |
M0 |
M1 |
M2 |
|
300 |
0 |
0 |
0 |
|
400 |
0,0392 |
0,013 |
0,0043 |
|
500 |
0,1133 |
0,0407 |
0,0149 |
|
600 |
0,1962 |
0,0759 |
0,0303 |
|
700 |
0,2794 |
0,1153 |
0,0498 |
|
800 |
0,3597 |
0,1574 |
0,0733 |
|
900 |
0,4361 |
0,2012 |
0,1004 |
При Т=300 К
∆G0300 = -22,375 + 33,6*300/1000 –300*(0*1,788 + 0*101,454 – 55,427*0)
∆G0300 = -12,3 ккал
При Т=400 К
∆G0400 = -22,375 + 33,6*400/1000 –400*(0,0392*1,788 + 0,3*101,454 – 55,427*0)
∆G0400 = -37,4 ккал
При Т=500 К
∆G0500 = -111,3 ккал
При Т=600 К
∆G0600 = -226,8 ккал
При Т=700 К
∆G0700 = -375,9 ккал
При Т=800 К
∆G0800 = -549,8 ккал
При Т=900 К
∆G0900 = -741,2 ккал
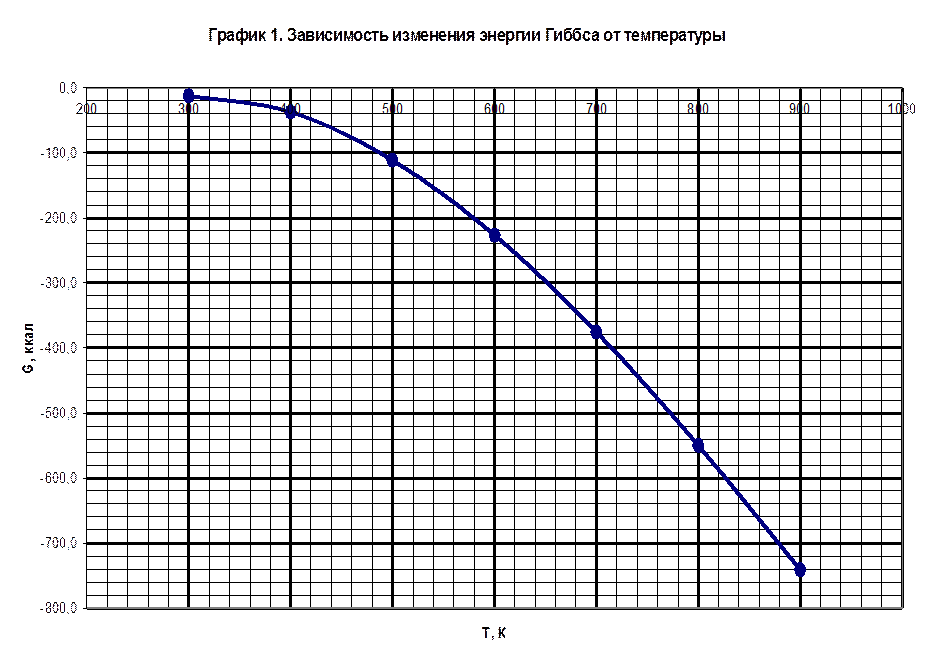
|
T, К |
∆G, ккал |
|
300 |
-12,3 |
|
400 |
-37,4 |
|
500 |
-111,3 |
|
600 |
-226,8 |
|
700 |
-375,9 |
|
800 |
-549,8 |
|
900 |
-741,2 |
Реакции находятся на удалении от состояния равновесия (т.к ∆G≠0),
Так как ∆G<<0, то равновесие реакции смещено в сторону образования продуктов реакции, в сторону прямой реакции.
IV Этап
Вычислить lnKf и Kf для интервала Т с шагом 1000. Построить н\графики зависимости lnKf и Kf от Т.
∆G0Т = - RTlnKf – нормальное хим. сродство.
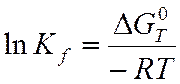 ,
где R=1,987 кал/к
,
где R=1,987 кал/к
При Т=300 К
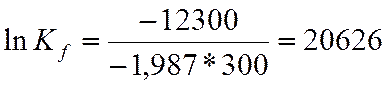
по аналогии рассчитываем lnKf для других температур.
|
T |
LnKf |
Kf |
|
300 |
20,626 |
9,07E+08 |
|
400 |
47,071 |
2,77E+20 |
|
500 |
112,029 |
4,50E+48 |
|
600 |
190,244 |
4,19E+82 |
|
700 |
270,239 |
2,31E+117 |
|
800 |
345,882 |
1,64E+150 |
|
900 |
414,467 |
1,00E+180 |
V Этап
Составить закон действующих масс через отношение летучестей.
С2Н4 + С3Н6 → C5H10
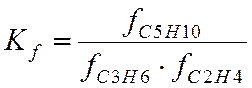
f = γ*p
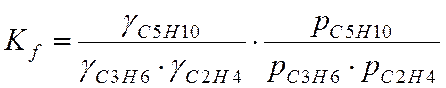
![]()
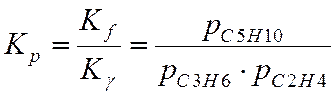
VI Этап
Для химической реакции определить приведенные давления для давлений 1; 50; 100; 150 атм и приведенные температуры для указанного интервала с шагом 1000С. По приведенным давлениям и температурам определить коэффициент фугитивности γ.
τ=Т/Ткр π=р/ркр
|
Вещество |
р, атм |
ркр, атм |
π |
Т, К |
Ткр, К |
τ |
γ |
|
С2Н4 |
1 |
50,5 |
0,020 |
300 |
283 |
1,060 |
1 |
|
1 |
50,5 |
0,020 |
400 |
283 |
1,413 |
1 |
|
|
1 |
50,5 |
0,020 |
500 |
283 |
1,767 |
1 |
|
|
1 |
50,5 |
0,020 |
600 |
283 |
2,120 |
1 |
|
|
1 |
50,5 |
0,020 |
700 |
283 |
2,473 |
1 |
|
|
1 |
50,5 |
0,020 |
800 |
283 |
2,827 |
1 |
|
|
1 |
50,5 |
0,020 |
900 |
283 |
3,180 |
1 |
|
|
С2Н4 |
50 |
50,5 |
0,990 |
300 |
283 |
1,060 |
0,73 |
|
50 |
50,5 |
0,990 |
400 |
283 |
1,413 |
0,91 |
|
|
50 |
50,5 |
0,990 |
500 |
283 |
1,767 |
0,97 |
|
|
50 |
50,5 |
0,990 |
600 |
283 |
2,120 |
0,98 |
|
|
50 |
50,5 |
0,990 |
700 |
283 |
2,473 |
0,98 |
|
|
50 |
50,5 |
0,990 |
800 |
283 |
2,827 |
0,99 |
|
|
50 |
50,5 |
0,990 |
900 |
283 |
3,180 |
1 |
|
|
С2Н4 |
100 |
50,5 |
1,980 |
300 |
283 |
1,060 |
0,48 |
|
100 |
50,5 |
1,980 |
400 |
283 |
1,413 |
0,83 |
|
|
100 |
50,5 |
1,980 |
500 |
283 |
1,767 |
0,93 |
|
|
100 |
50,5 |
1,980 |
600 |
283 |
2,120 |
0,96 |
|
|
100 |
50,5 |
1,980 |
700 |
283 |
2,473 |
0,97 |
|
|
100 |
50,5 |
1,980 |
800 |
283 |
2,827 |
0,98 |
|
|
100 |
50,5 |
1,980 |
900 |
283 |
3,180 |
0,99 |
|
|
С2Н4 |
150 |
50,5 |
2,970 |
300 |
283 |
1,060 |
0,38 |
|
150 |
50,5 |
2,970 |
400 |
283 |
1,413 |
0,76 |
|
|
150 |
50,5 |
2,970 |
500 |
283 |
1,767 |
0,9 |
|
|
150 |
50,5 |
2,970 |
600 |
283 |
2,120 |
0,96 |
|
|
150 |
50,5 |
2,970 |
700 |
283 |
2,473 |
0,97 |
|
|
150 |
50,5 |
2,970 |
800 |
283 |
2,827 |
0,98 |
|
|
150 |
50,5 |
2,970 |
900 |
283 |
3,180 |
0,99 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.