








Завдання
Провести термодинамічний аналіз рівноважної системи, що утворилася внаслідок перебігу заданих хімічних реакцій в заданому інтервалі температур і тисків між газоподібними речовинами, які вважатимемо ідеальними газами:
Реакція №1
Реакція №2
Теоретична частина
Теплоємність – це кількість теплоти, яка потрібна для нагрівання системи на один градус. Розрізняють теплоємність:
· питома - віднесена до 1 г речовини;
· молярна - віднесена до 1 моля речовини;
· істинна - дорівнює відношенню нескінченно малої кількості теплоти, до нескінченно малого підйому температури, який при цьому спостерігається: С=δQ/d T
· середня – відношення середньої кількості теплоти, до підйому температури, який при цьому спостерігається С = Q/(T2 – T1)
С°p = a + b*T + c*T2 + c'/Т2
Тепловий ефект реакції – це кількість енергії, яка поглинається або вивільняється системою внаслідок проходження хімічної реакції.
![]()
![]() T =∆H0 +
T =∆H0 + ![]() , де ΔH0 – тепловий ефект реакції при Т = 0 К;
, де ΔH0 – тепловий ефект реакції при Т = 0 К;
![]() HT =
HT = ![]() H0 +
H0 + ![]()
![]() HT =
HT = ![]() H298 +
H298 + ![]() – рівняння Кірхгофа в інтегральній
формі;
– рівняння Кірхгофа в інтегральній
формі;
∆Н0т=∆Н0298+∆а*(Т-298) + (∆в/2) *(Т2-298) + (∆с/3)* (Т3-2983) - ∆с’*(Т-1 -298-1)
При фіксованих Р чи V теплота процесу дорівнює зміні ентальпії чи внутрішньої енергії. Відповідно і сама теплота перетворюється на властивість системи і не залежить від шляху процесу, а визначається початковим і кінцевим станом. Тепловий ефект реакції дорівнює алгебраїчні сумі теплоти утворення реагентів:
∆Н°=∑ ν,∆ƒН°прод.-∑ ν,∆ƒН°вихід.
Ентропія – це та частина тепла, яка витрачається на розподіл фази по об’єму.
![]()
![]() - залежність ентропії від
теплоємності;
- залежність ентропії від
теплоємності;
∆S0т = ∆S0298 + ∆а∙ln(T/298) + ∆b∙(T - 298) + ∆c/2∙(T2 – 2982) - ∆c'/2∙(T-2 – 298-2)
Енергія Гіббса або ж вільна ентальпія – це фізична величина, яка дорівнює:
![]()
де T![]() S
S![]() – це та частина
енергії, яка обов’язково загубиться внаслідок дисипації в системі і не може
бути перетворена в роботу.
– це та частина
енергії, яка обов’язково загубиться внаслідок дисипації в системі і не може
бути перетворена в роботу.
Енергія Гіббса – це ізобарно-ізотермічний потенціал.
(H2-TS2)-(H1-TS1)≤0 (P,T)= const.
G2-G1≤0; ∆G>0 ←
G=H-TS; ∆G<0→
∆G≤0; ∆G=0↔
При сталих значеннях Т,Р необхідні процеси протікають в напрямку зменшення ізобарно-ізотермічних потенціалів, а в стані рівноваги зміна ізобарно-ізотермічних потенціалів дорівнює нулю.
G = H – TS = U + pV – TS = U - (TS) + рV = A + рV
Залежність ізобарно-ізотермічного потенціалу від Р,Т.
δQ = dH - VdP; G=f(T,P)
dG =( ∂G/ ∂T)*PdP +( ∂G/ ∂P)TdT;
(∂G/ ∂T)P=-S; (∂G/ ∂P)T=V.
∆G°=-RTlnK. ∆G°=f (T)
Константа рівноваги – це кількісна характеристика стану рівноваги системи.
Кр0 = exp(-∆G0Т / RT)
lnKp0 = -∆G0T / RT
aA + bB→cC + dD
A, B – вихідні речовини;
С, D – продукти;
a, b, c, d – стехіометричні коефіцієнти.
Кр0 = (рСс + рDd) / (pAa + pBb)
Способи вираження константи рівноваги.
K=Kp *p°, p°=1атм. = 1,013*10 Па.
Kp =Kc ∙(RT)Σν
Kp =Kn*p Σν
Вплив інертних домішок на рівновагу в системі.
Ni=ni/Σni
Σni = n1 + n2 + n3 + … + ni
N1 = n1 / (n1 + n2)
Розрахункова частина
1. Розрахунок і аналіз термодинамічних характеристик складних реакцій
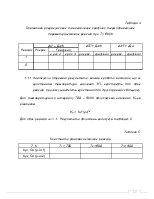
1.1 Термодинамічні характеристики реагуючих речовин, що необхідні для подальших розрахунків, взяті з довідника [3 ], наведені в таблиці 1.
Таблиця 1
Термодинамічні характеристики речовин, що реагують
|
Речовина |
ΔfH°298, кДж/моль |
S°298, Дж/моль*К |
С°p = a + b*T + c*T2 + c'/Т2 Дж/моль*К |
|||
|
а |
b*103 |
c*106 |
c'*10-6 |
|||
|
Пропан |
||||||
|
Етилен |
||||||
|
Метан |
||||||
|
Бутан |
||||||
|
Етан |
||||||
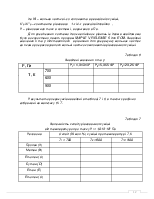
1.2 Розраховую зміну термодинамічних характеристик для заданих реакцій при 298К.
ü Для реакції 1:
ΔH°298 =
ΔS°298 =
Δа =
Δb =
Δс =
∆с' =
ü Для реакції 2:
ΔH°298 =
ΔS°298 =
Δа =
Δb =
Δс =
∆с' =
Одержані результати записую в таблицю 2.
Таблиця 2
Термодинамічні характеристики заданих реакцій
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.