Термодинамическая возможность протекания этих реакций (изменение свободной энергии Гиббса) меняется в зависимости от условий (температура, состав расплава, давление и т.д.). Для определения условий окисления углерода без значительного угара хрома принято рассматривать суммарное взаимодействие по реакции (2.3), отвечающей сумме реакций (2.1) и (2.2)
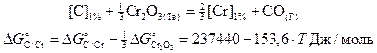 .
(2.3)
.
(2.3)
За стандартное состояние для растворённых углерода и хрома принят гипотетический бесконечно-разбавленный 1%-ый раствор в жидком железе, для СО – чистый газообразный монооксид углерода при давлении 1 атм., для оксидов хрома в шлаке – чистый твёрдый Cr2O3. Константа равновесия реакции (2.3) имеет вид
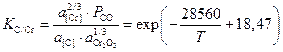 .
(2.4)
.
(2.4)
При продувке в
открытой дуговой печи можно принять РСО = 1. При
окислительном рафинировании хромсодержащих расплавов образуются вязкие
гетерогенные шлаки, насыщенные Cr2O3
и поэтому можно принять, что ![]() .
Так как
.
Так как ![]() и
и ![]() (см. приложение Д), то
(см. приложение Д), то
![]() . Перепишем (2.4) с учётом
всех допущений
. Перепишем (2.4) с учётом
всех допущений
![]() .
(2.5)
.
(2.5)
По уравнению (2.5) можно рассчитать содержание углерода, которое можно получить при окислительном рафинировании хромсодержащего расплава в открытом агрегате (например, ДСП), до начала интенсивного окисления хрома.
Рассчитаем коэффициента активности углерода для состава жидкого полупродукта вариант №0 ([Cr] = 18%, [Ni] = 9%) c учётом температурной зависимости в рамках теории регулярных растворов
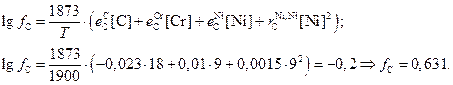
Здесь произведение
![]() примем равным нулю, в
противном случае выражение (2.5) примет вид трансцендентного уравнения, которое
решается численными методами или графически, так как не имеет аналитического
решения. При высоких концентрациях никеля необходимо использовать массовый
параметр взаимодействия второго порядка
примем равным нулю, в
противном случае выражение (2.5) примет вид трансцендентного уравнения, которое
решается численными методами или графически, так как не имеет аналитического
решения. При высоких концентрациях никеля необходимо использовать массовый
параметр взаимодействия второго порядка ![]() . Константа равновесия
реакции (2.3) при 1927 °С равна
. Константа равновесия
реакции (2.3) при 1927 °С равна
![]() .
.
Подставляя значения
![]() и
и ![]() в (2.5), получаем
в (2.5), получаем
![]() .
.
Таким образом, при кислородной продувке жидкого полупродукта коррозионностойкой стали состава варианта №0 можно получить концентрацию углерода 0,35% до начала интенсивного окисления хрома.
В агрегате вакуум-кислородного рафинирования (VOD – Vacuum Oxygen Decarburization) парциальное давление СО меньше единицы. В этом случае можно получить пониженную равновесную концентрацию углерода до начала интенсивного окисления хрома
![]() .
(2.6)
.
(2.6)
Для варианта №0 РСО = 0,1 атм., тогда
![]() .
.
Таким образом, продувка кислородом в вакууме позволяет получать более низкие, по сравнению с рафинированием в открытом агрегате, концентрации углерода при минимальном угаре хрома.
Помимо давления, существенное влияние на равновесную концентрацию углерода оказывает температура. Оценим температуру, при которой можно получить в жидком полупродукте 0,1% углерода без интенсивного окисления хрома. Прологарифмируем выражение (2.5)
![]() .
.
Зависимость коэффициента активности углерода от температуры в рамках теории регулярных растворов имеет вид
![]() .
.
Подставляя полученное выражение в (2.6), имеем
![]() .
.
Откуда
![]() .
.
Таким образом, если продувку кислородом в ДСП проводить не при 1627 °С, а при температуре 1794 °С, то можно получить в жидком полупродукте коррозионностойкой стали не 0,35%, а 0,1% углерода; и при этом без значительного окисления хрома.
Если при 1627 °С продолжить окислять углерод от равновесного значения 0,35% до (0,35 – 0,10) = 0,25%, то это будет сопровождаться значительным окислением хрома. Конечное содержание хрома в жидком полупродукте коррозионностойкой стали, равновесное с 0,25% [С] можно получить из уравнению (2.5)
![]() . (2.7)
. (2.7)
Примем допущение,
что коэффициент активности углерода в ходе дальнейшей продувки остаётся
неизменным и равен значению, полученному ранее ![]() .
.
Подставив в (2.7)
значения [C], ![]() и
и ![]() , получим
, получим
![]() .
.
Тогда угар хрома, отвечающий окислению углерода с 0,35 до 0,25% при 1627 °С в открытом агрегате, составит
![]() .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.