|
Qij, кДж/моль |
FeO |
MnO |
CaO |
MgO |
SiO2 |
Р2О5 |
|
FeO |
0 |
0 |
0 |
0 |
0 |
0 |
|
MnO |
0 |
0 |
0 |
0 |
-42 |
0 |
|
CaO |
0 |
0 |
0 |
0 |
-113 |
-200 |
|
MgO |
0 |
0 |
0 |
0 |
-113 |
0 |
|
SiO2 |
0 |
-42 |
-113 |
-113 |
0 |
0 |
|
Р2О5 |
0 |
0 |
-200 |
0 |
0 |
0 |
Состав шлака варианта
№ 0 (массовая доля, %): FeO
– 18, MnO
– 6, CaO
– 44, MgO
– 7, SiO2
– 21, Al2O3
– 4. В.А. Кожеуров не рассматривал оксид алюминия в своих шлаках, но, как
правило, Al2O3
в этих системах ведёт себя как нейтральный компонент и можно принять, что его
энергии смешения равны нулю со всеми оксидами (![]() ).
).
Для нахождения ионных долей катиона воспользуемся следующими молярными массами оксидов (г/моль): FeO – 72, MnO – 71, CaO – 56, MgO – 40, SiO2 – 60, Al2O3 – 102. Рассчитаем количество молей катионов Ʃni в 100 граммах шлака. В дальнейших расчетах, масса шлака сокращается, поэтому удобно использовать 100 грамм шлака, так как в этом случае процентное содержание оксида численно равно его массе:
![]()
![]() .
.
Отношение массовой доли оксида алюминия к его молярной массе необходимо умножить на 2, так как Al2O3 содержит два катиона металла. Для нахождения ионной доли катионов разделим количество молей соответствующего катиона ni на общее число молей всех катионов Ʃni:
![]() ;
; ![]()
![]() ;
; ![]() .
.
Ионные доли катионов целесообразно округлять до третьего знака после запятой. Выражение для коэффициента активности катиона железа (1.9) удобно использовать в виде:
![]() .
.
При температуре 1600 °С (1873 К) для шлака заданного состава получаем
![]() .
.
Активность FeO в шлаке при 1600 °С
![]() .
.
Для расчета равновесного кислорода и углерода под шлаком заданного состава необходимо знать константы равновесия. При 1873 К КFeO = 4,39 и КC = 114 (см. приложение Е).
Равновесное содержание кислорода под заданным шлаком:
![]() .
.
Равновесное содержание углерода под заданным шлаком:
![]() .
.
Содержания элементов целесообразно округлять до тысячных долей процентов.
Процесс дефосфорации под окислительным шлаком описывают реакцией [5]:
![]() .
(1.11)
.
(1.11)
За стандартное состояние фосфора принят гипотетический однопроцентный раствор фосфора в жидком железе, обладающий свойствами бесконечно разбавленного; для оксида фосфора – чистый жидкий P2O5. Константа равновесия реакции (1.11) KP имеет вид
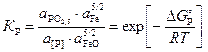 ,
(1.12)
,
(1.12)
где ![]() – активность оксида РО2,5
в шлаке;
– активность оксида РО2,5
в шлаке;
a[Р] – активность фосфора в жидком железе.
Примем, что жидкий
металл – практически чистое железо, тогда ![]() . Подставляя
. Подставляя ![]() и
и ![]() в
(1.12) получаем
в
(1.12) получаем
![]() .
(1.13)
.
(1.13)
Коэффициент
распределения фосфора LP
часто используют в виде LP
= (P)/[P],
где (P)
– массовая доля фосфора в шлаке, %. Ионная доля катиона фосфора в шлаке связана
с его массовой долей соотношением ![]() , так как
, так как ![]() . Молярная масса фосфора 31
г/моль, тогда (1.13) примет вид
. Молярная масса фосфора 31
г/моль, тогда (1.13) примет вид
![]() . (1.14)
. (1.14)
Выражение (1.14)
позволяет по известным составам металла (fP)
и шлака (![]() ), и заданной
температуре (KP)
рассчитать коэффициент распределения фосфора. Для расчетов выражение (1.14)
удобно использовать в логарифмическом виде. Учтём, что
), и заданной
температуре (KP)
рассчитать коэффициент распределения фосфора. Для расчетов выражение (1.14)
удобно использовать в логарифмическом виде. Учтём, что ![]() и lgKP
= 1074/T –1,289. Тогда
и lgKP
= 1074/T –1,289. Тогда
![]() . (1.15)
. (1.15)
Коэффициент активности катиона фосфора в шлаке можно найти по уравнению (1.10)
![]()
Значения
параметров взаимодействия из приложения 5 ![]() , начальное содержание
фосфора для варианта № 0 [P]
= 0,050%.
, начальное содержание
фосфора для варианта № 0 [P]
= 0,050%.
![]()
![]()
Для определения конечного содержания фосфора в жидком металле составим систему уравнений
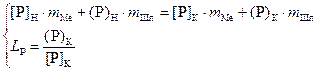 ,
(1.16)
,
(1.16)
где mMe, mШл – массы металла и шлака соответственно;
[P]H, [P]K, (P)H, (P)K – начальные и конечные содержания фосфора в металле и шлаке, %.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.