Исходные данные – температура процесса, исходное содержание фосфора в жидкой стали, состав окислительного шлака, содержание легирующего и примесного элементов – приведены в приложении А. Для выполнения домашнего задания по теме «Дефосфорация жидкой стали» требуется:
1) Определить содержания кислорода и углерода в стали, приняв, что окисленность жидкого полупродукта контролируется окисленностью шлака для двух температур.
2) Определить коэффициент распределения фосфора для данного состава шлака для двух температур, степень дефосфорации и конечное содержание фосфора в жидкой стали при кратности шлака 5 и 10% соответственно. Сделать вывод о влиянии количества шлака на процесс дефосфорации.
3) Определить количество шлака (кратность в %) данного состава, необходимое для получения 0,005% фосфора в жидкой стали, при заданном начальном содержании фосфора в шихте при двух температурах.
4) Построить зависимости коэффициента распределения фосфора от температуры (в интервале значений от 1550 до 1800 °С) и от окисленности системы (активности FeO в интервале значений от 0,1 до 0,4). Сделать вывод о влиянии температуры и окисленности системы на процесс дефосфорации.
5) Определить количество шлака (кратность в %) данного состава, необходимое для получения 0,005% фосфора в жидкой стали, при заданном начальном содержании фосфора в шихте и содержании примесного элемента при температуре 1550 °С. Сделать вывод о влиянии примесного элемента на процесс дефосфорации.
Решение варианта № 0.
Распределение кислорода между металлом и шлаком описывается реакцией
![]() ,
(1.1)
,
(1.1)
где
![]() –
изменение стандартной энергии Гиббса реакции, Дж/моль;
–
изменение стандартной энергии Гиббса реакции, Дж/моль;
Т – температура, К.
За стандартное состояние железа принято – чистое жидкое железо, FeO – чистый жидкий оксид, для растворенного кислорода – гипотетический однопроцентный раствор кислорода в жидком железе, обладающий свойствами бесконечно разбавленного (здесь и далее символ 1%). В приложении Е приведены термодинамические данные наиболее распространенных реакций, используемых при расчетах металлургических процессов. Константа равновесия реакции (1.1) KFeO имеет вид
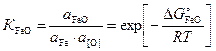 ,
(1.2)
,
(1.2)
где R = 8,314 Дж/(моль·К) – универсальная газовая постоянная;
aFeO – активность оксида железа в шлаке;
aFe – активность железа в жидком металле;
a[O] – активность кислорода в жидком металле.
Поскольку жидкий
металл представляет собой практически чистое железо, то ![]() . Активность кислорода равна
произведению концентрации кислорода (массовая доля, %) на коэффициент
активности
. Активность кислорода равна
произведению концентрации кислорода (массовая доля, %) на коэффициент
активности ![]() . Коэффициент
активности кислорода можно найти по массовым параметрам взаимодействия. По
данным справочника Steelmaking Data Sourcebook [1] при 1600 °С параметр
. Коэффициент
активности кислорода можно найти по массовым параметрам взаимодействия. По
данным справочника Steelmaking Data Sourcebook [1] при 1600 °С параметр ![]() .
Максимальная растворимость кислорода в жидком железе под шлаком из чистого FeO по данным Тейлора и Чипмана [2] при 1600 °С составляет
.
Максимальная растворимость кислорода в жидком железе под шлаком из чистого FeO по данным Тейлора и Чипмана [2] при 1600 °С составляет ![]() или [O]max
= 0,229%, при этом коэффициент активности будет равен
или [O]max
= 0,229%, при этом коэффициент активности будет равен ![]() или fO
= 0,912. Содержание FeO в реальных
металлургических (электросталеплавильных и конвертерных) шлаках, как правило,
не превышает 40%, и равновесное содержание кислорода в несколько раз меньше
максимального значения. Поэтому можно принять, что
или fO
= 0,912. Содержание FeO в реальных
металлургических (электросталеплавильных и конвертерных) шлаках, как правило,
не превышает 40%, и равновесное содержание кислорода в несколько раз меньше
максимального значения. Поэтому можно принять, что ![]() . Если окисленность металла
контролируется окисленностью шлака, то равновесное содержание кислорода можно
найти из выражения для константы равновесия KFeO:
. Если окисленность металла
контролируется окисленностью шлака, то равновесное содержание кислорода можно
найти из выражения для константы равновесия KFeO:
![]() .
(1.3)
.
(1.3)
Взаимодействие углерода, растворенного в жидком металле, со шлаком описывается реакцией
![]() .
(1.4)
.
(1.4)
За стандартное состояние углерода принят гипотетический однопроцентный раствор углерода в жидком железе, обладающий свойствами бесконечно разбавленного, для оксида углерода – чистый газообразный оксид СО под давлением 1 атм. (1 атм. – внесистемная единица, равная 101325 Па). Константа равновесия реакции (1.4) KС имеет вид
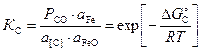 ,
(1.5)
,
(1.5)
где РСО – парциальное давление СО в газовой фазе;
a[С] – активность углерода в жидком металле.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.