2) Гидролитическое расщепление
Гидролиз катализируется как кислотами, так и щелочами; идет по амидной (лактамной) и азометиновой связям. Продуктами гидролиза являются аминокетоны и аминохинолоны, образующиеся из промежуточного соединения:
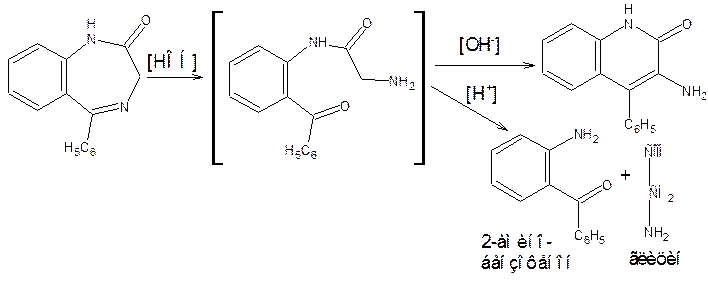
3) Образование азокрасителя после кислотного гидролиза
Препараты, не имеющие заместителя у атома азота в положении 1 (феназепам, нозепам, нитразепам) после кислотного гидролиза за счет образовавшейся первичной ароматической аминогруппы дают соль диазония, и затем – азокраситель.
Реакция диазотирования лежит в основе нитритометрического метода количественного определения.
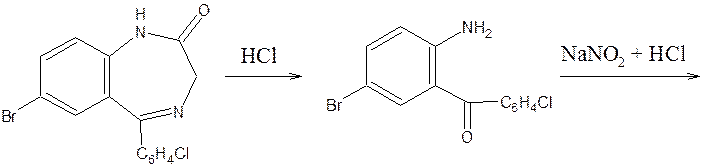
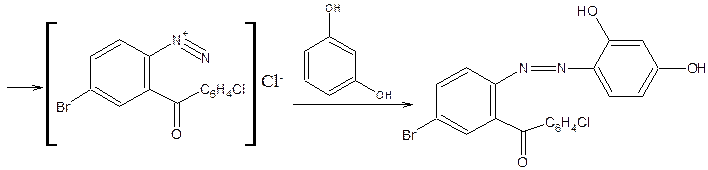
4) Открытие галогенов
Органически связанные атомы галогенов определяют после минерализации, для чего можно использовать метод сжигания в кислороде. Кроме того, проба Бейльштейна.
5) С осадительными реактивами:
пикриновой кислотой – желтый осадок
реактив Бушарда - бурый осадок
6) По УФ-спектрам
феназепам - lmax = 320 нм;
нитразепам - lmax = 280 нм; и т.д.
7) У бензодиазепинов с нитрогруппой в положении 7 возможна реакция азосочетания после восстановления нитрогруппы до аминогруппы (нитразепам). В качестве азосотавляющей используют N-(1-нафтил)-этилендиамин (реакция Браттона-Маршалла).
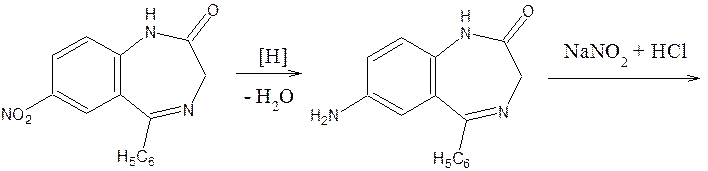
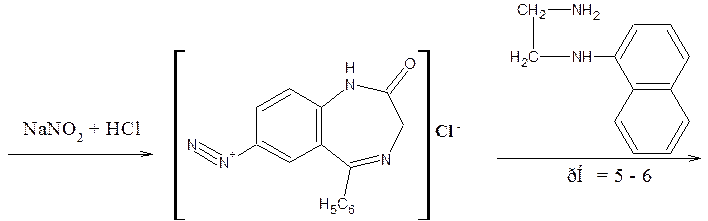
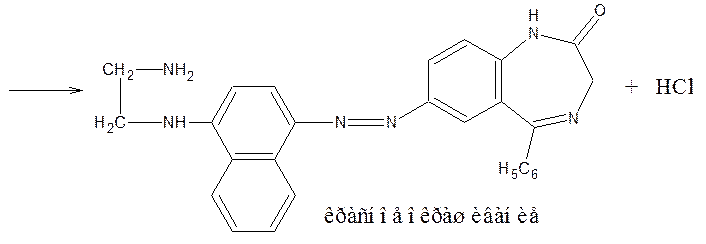
8) Бензодиазепины с активной метиленовой группой (нитразепам, диазепам, нордиазепам) дают положительную реакцию с 4-диметиламинобензальдегидом, видимым эффектом является красное окрашивание.
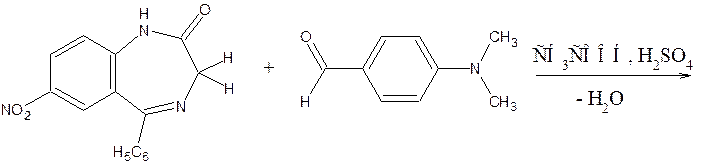
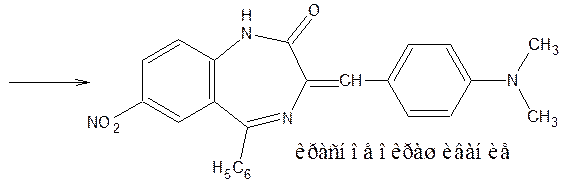
9) Сминеральными кислотами препараты данной группы образуют окрашенные соединения, флуоресцирующие в УФ-свете (это свойство используется и для количественного определения методом флуориметрии). Например, с хлорной или серной кислотой:
|
Окраска раствора |
Флуоресценция в УФ-свете при 254 нм |
|
|
Феназепам (ГФ) |
Бесцветная или слегка желтая |
Ярко-зеленая |
|
Диазепам |
Слабая зеленовато-желтая |
Слабая зеленовато-голубая |
|
Нитразепам |
Желтая |
Слабо-голубая |
10) Наличие в молекуле бензодиазепинов лактамной функциональной группы используют для идентификации препаратов по образованию гидроксамовых кислот, дающих цветную реакцию с солью Fe (III). Но поскольку гидроксиламин может вступать и в реакцию образования оксимов, используют не заводского производства реактив, а получают в момент выделения (реактив Годди: HCl – водный аммиак – NaOH – CH3OH)
HCl + NH4OH + CH3OH ® NH2–OH * HCl + H2O + CH4
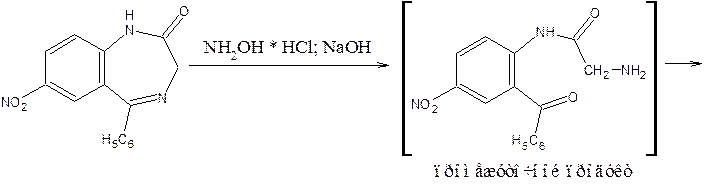
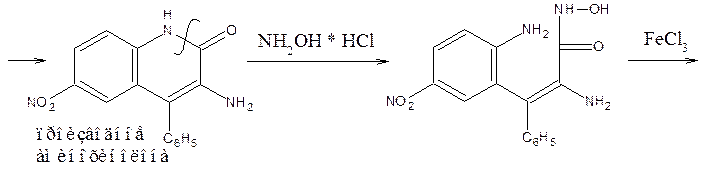
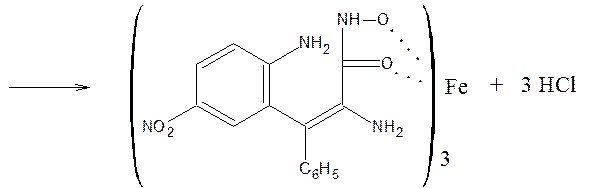
11) Особенности структуры обусловливают возможность идентификации оксазепама по продукту гидролиза амидокарбинольной группы – формальдегиду, который восстанавливает хиноидную структуру, фуксина (появляется фиолетовое окрашивание):

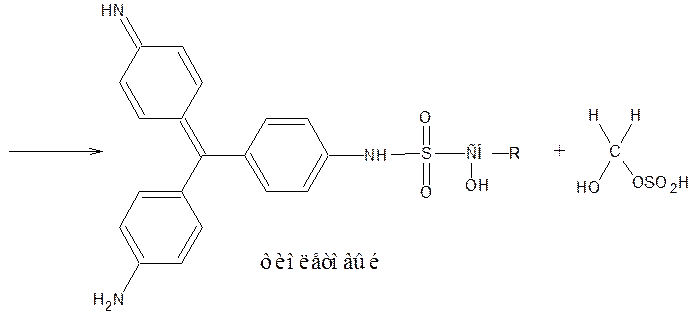
12) Многие бензодиазепины образуют окрашенные плавы. Так феназепам при нагревании в сухой пробирке образует плав фиолетового или красно-фиолетового цвета, окраска плава меняется в зависимости от значения рН среды:
при добавлении раствора NaOH – красно-фиолетовая;
окраска плава в 95% этаноле переходит в сине-фиолетовую;
при добавлении разв. H2SO4 – в сине-зеленую, затем в желтую.
По видимому, при плавлении феназепама образуется соединение со свойствами кислотно-основного индикатора. У структурных аналогов (нитразепама, сибазона) при плавлении образуются плавы зеленого цвета, и окраска спиртовых растворов этих плавов не изменяется от рН.
Таким образом, можно отличить феназепам от других лекарственных средств.
13) ГФ: Тонкослойная хроматография на пластинках «Силуфол УФ-254».
Методы количественного анализа
1) Кислотно-основное титрование в неводных средах
Титрант – 0,1 н HСlO4; среда – уксусный ангидрид; индикатор – кристаллический фиолетовый.
Суммарно:
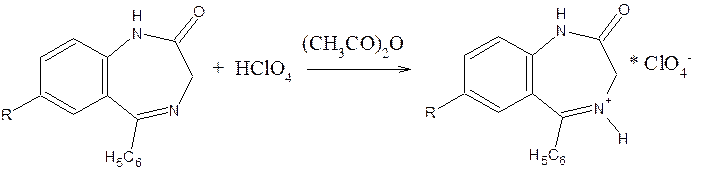
2) Фотоколориметрия – по реакции образования азокрасителя.
3) УФ-спектрофтометрия
4) Флуориметрия – используют свойство бензодиазепинов флуоресцировать в растворе кислот. Зачастую для повышения интенсивности флуоресценции препараты подвергают химическому, фотохимическому и термическому воздействию. Так флуоресценция оксазепама достигается нагреванием до 120оС в течение 10-20 минут его раствора в 70% HClO4.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.