Tuesday, November 17, 2015
ГЛАВА 4.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химическое равновесие является особой разновидностью состояния химической реакционной системы. Оно характеризуется таким составом системы, который обеспечивает протекание обратимых реакций между составляющими систему веществами, а также неизменность во времени параметров состояния системы и вследствие этого максимальную устойчивость системы.
Химическое равновесие обладает подвижностью и способно самопроизвольно восстанавливаться после небольших отклонений от состояния равновесия. Естественно, что состав реакционной равновесной системы постоянен до тех пор, пока сохраняются условия его существования.
Рассматривать химическое равновесие можно с двух позиций: с кинетической и термодинамической. Это непосредственно вытекает из того, что любую химическую реакцию можно описывать как с позиций кинетики, так и с позиций термодинамики.
4.1 . ПРИРОДА ХИМИЧЕСКОГО
РАВНОВЕСИЯ
Кинетический(динамический) характер химического равновесия.
Из кинетики известно, что химические реакции одновременно с конечными скоростями протекают в двух направлениях - в сторону образования продуктов реакции (прямая реакция) и в обратном направлении (обратная реакция). Вследствие этого явления, называемого химической обратимостью реакция никогда до конца не доходит. В тот момент, когда скорости прямого и обратного процессов сравниваются, наступает химическое равновесие. Хорошо демонстрирует динамический характер химического равновесия вывод константы равновесия на основе применения закона действующих масс. В соответствии с этим законом для простой реакции вида (4.1) можно записать:
a1A1 + a2A2 + a3A3 +...+ akAk = b1B1 + b2B2 + b3B3 +...+ bkBk (4.1)
прямая реакция (4.2)
обратная реакция (4.3)
Поскольку условием равновесия является равенство v1 = v2, то, приравнивая правые части уравнений (4.2) и (4.3) имеем:
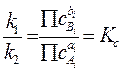 (4.4)
(4.4)
Здесь Кс константа
равновесия, постоянная величина, характеризующая реакцию (4.1). Подстрочный индекс
"с" в обозначении константы равновесия указывает, что эта константа
является концентрационной и определена через концентрации веществ. Если
воспользоваться соотношением между концентрацией и активностью вещества (типа а=ус)
и определить константу через активности веществ, тогда выражение для нее примет
вид 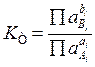 и она будет называться термодинамической.
и она будет называться термодинамической.
Физический смысл константы равновесия можно связать с тем, что она показывает, во сколько раз константа скорости прямой реакции больше константы скорости обратной реакции (см. равенство 4.4).
С
учетом вытекающей из уравнения состояния идеального газа (1.3) взаимосвязи
между парциальными давлениями реагирующих газов и их концентрациями формулу (4.4)
можно представить, заменив концентрации соответствующих веществ их парциальными
равновесными давлениями (![]() ):
):
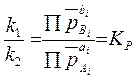 (4.5)
(4.5)
Для любой реакции диссоциации константу равновесия можно выразить через степень диссоциации a - долю (от исходного количества) продиссоциировавших молекул вещества. Для соединения вида МА ( где М и А однозарядные катион и анион соответственно) можно записать реакцию диссоциации: МА = М+ + А-. Поэтому константа равновесия, соответствует константе диссоциации и равняется:
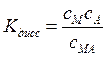 (4.6)
(4.6)
Если принять, что аналитическая концентрация растворенной соли МА равна сан., то с учетом того, что см= сА = a сан. , а концентрация недиссоциированных молекул растворенного вещества сМА равна (1 - a) сан. получим:
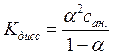 (4.7)
(4.7)
Полученная формула представляет собой известное выражение для закона разбавления Оствальда (для бинарного электролита).
Итак, в равновесном состоянии, при неизменных термодинамических условиях реакции концентрации, реагирующих веществ оказываются постоянными и, как следует из закона действующих масс, соответствуют отношению констант скоростей прямой и обратной реакций.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.