С термодинамической точки зрения химические реакции необратимы, поскольку до наступления равновесия они протекают с конечными скоростями. Тем не менее, можно мысленно представить, что эти реакции в обоих направлениях протекают бесконечно медленно, через равновесные состояния. Это означает, что при постоянстве концентраций и неизменных внешних условиях они термодинамически обратимы, а равновесная реакционная система должна характеризоваться общими условиями термодинамического равновесия. Эти условия для конкретной ситуации представлены в таблице 1.6. Например, если равновесная реакционная система находится при постоянных давлении и температуре, то условием равновесия для этой системы будет равенство нулю изменения энергии Гиббса, т.е. DG = 0.
Гетерогенную систему удобно характеризовать термодинамическими условиями равновесия, выраженными с помощью представлений о химическом потенциале, т.е.:
åmidni = 0 (4.8)
Таким образом, химическое равновесие обладает кинетическими и термодинамическими характеристиками.
4.2. ИЗОТЕРМА ХИМИЧЕСКОЙ РЕАКЦИИ
Особенно выразительно двойственная природа химического равновесия проявляется при рассмотрении вывода изотермы химической реакции.
Рассмотрим уравнение химической реакции, записанное в общем виде (см. выражение 4.1).
Предположим, что реакция протекает в газовой фазе при постоянных температуре и давлении. Пусть реагенты имеют свойства идеального газа. В этом случае изменение энергии Гиббса можно выразить уравнением:
DG = b1m1 + b2m2+. . . .-(a1m1 + a2m2 +. . . ) (4.9)
С учетом того, что для идеального газа mi(T) = mi0(Т) + RTlnpi (1.64). можно записать, что
DG = å[bimi0(Т) ] + RTå[bi lnp(Bi)] -å[(aimi0(Т) -RTå[ailnp(Bi)] (4.10)
Обозначим:
å[bimi0(Т) ] -å[(aimi0(Т)] = DG о (4.11)
где DGо - постоянная для данной температуры величина, а также:
![]() и
и ![]() (4.12)
(4.12)
С учетом введенных обозначений уравнение (4.10) примет вид:
 (4.13)
(4.13)
Для равновесных условий DG = 0, поэтому
, а также 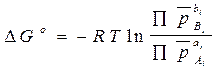 (4.14)
(4.14)
Поскольку DG
о и RT постоянны, то и отношение 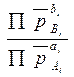 есть величина постоянная, соответствующая, как видно из уравнения (4.5)
константе равновесия реакции (4.1), т.е.:
есть величина постоянная, соответствующая, как видно из уравнения (4.5)
константе равновесия реакции (4.1), т.е.: 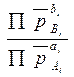 = Кр. С учетом этого соотношения и (4.14) нетрудно найти связь между изменением энергии Гиббса и
величиной Кр, которая имеет вид:
= Кр. С учетом этого соотношения и (4.14) нетрудно найти связь между изменением энергии Гиббса и
величиной Кр, которая имеет вид:
DGo = - RTln Кр, (4.15)
Сопоставляя уравнения (4.13) и (4.14) можно получить выражение:
 (4.16)
(4.16)
С учетом (4.15) имеем:
 (4.17)
(4.17)
Последнее
уравнение называется уравнением изотермы химической реакции. Его часто
используют для оценки направленности реакции при различных исходных составах
реакционной смеси. Для этого сравнивают значения Кр и 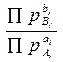 . Если константа равновесия
превышает отношение заданных парциальных давлений (или концентраций), то DG < 0 и, как видно из таблицы 1.6, реакция пойдет в
прямом направлении. Если наоборот, тогда DG >0 и следует ожидать, что
реакция пойдет в противоположном направлении.
. Если константа равновесия
превышает отношение заданных парциальных давлений (или концентраций), то DG < 0 и, как видно из таблицы 1.6, реакция пойдет в
прямом направлении. Если наоборот, тогда DG >0 и следует ожидать, что
реакция пойдет в противоположном направлении.
Величина константы равновесия зависит от способа выражения концентраций веществ, образующих равновесную систему. Поэтому используя уравнение состояния идеального газа p = сRT нетрудно перейти к выражению изотермы химической реакции с концентрационной константой равновесия, а с учетом связи между активностью вещества и его аналитической концентрацией – к записи изотермы с термодинамической константой равновесия.
4.3. ИЗОБАРА ХИМИЧЕСКОЙ РЕАКЦИИ
(зависимость константы равновесия от температуры)
С изменением температуры положение равновесия химической реакции смещается. Поэтому константа равновесия является функцией температуры.
Рассмотрим уравнение изотермы химической реакции (4.17). Отношение 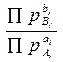 содержит произвольно задаваемые давления и поэтому от температуры
не зависит. Учитывая это, продифференцируем уравнение изотермы по температуре и
получим:
содержит произвольно задаваемые давления и поэтому от температуры
не зависит. Учитывая это, продифференцируем уравнение изотермы по температуре и
получим:
 (4.18)
(4.18)
Подставим в уравнение Гиббса - Гельмгольца (4.19), см. также (1.65):
(4.19) выражения для DG и , представленные уравнениями изотермы (4.17) и (4.18) соответственно. После некоторых преобразований полученного уравнения приходим к дифференциальной форме уравнения изобары химической реакции (изобара Вант –Гоффа):
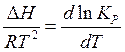 (4.20)
(4.20)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.