Аналогично, рассматривая процесс при постоянных объеме и температуре можно вывести уравнение изохоры химической реакции, которое имеет вид:
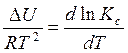 (4.21)
(4.21)
Дифференциальная форма изобары для практической работы неудобна. Поэтому ее обычно представляют в интегральной форме. Для этого разделим переменные и проинтегрируем уравнение (4.20):
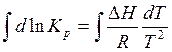 (4.22)
(4.22)
Чтобы проинтегрировать это уравнение надо знать зависимость теплового эффекта от температуры. При небольшом изменении температуры можно принять, что DH постоянна. Тогда результатом интегрирования будет:
 (4.23 а)
(4.23 а)
С учетом того, что DGo = - RTln Кр,, а также DGo = DHo - TDSo имеем
 (4.23
б)
(4.23
б)
Рассматривая влияние температуры, следует помнить, что речь по-прежнему идет об изотермических реакциях. Иначе говоря, температура процесса может быть разная, но в конкретном случае процесс проходит при постоянной температуре.
Из уравнений (4.23) видно, что в том случае, когда тепловой эффект реакции не зависит от температуры, график зависимости lnKpот 1/Т представляет собой прямую, с отрицательным градиентом (наклон прямой направлен слева направо; см. рис.4.1).

Рис. 4.1. Зависимость lnKpот 1/T.
Из рисунка видно, что тангенс угла наклона прямой равен - DH/R, а точка пересечения с осью координат дает величину В равную DS/R.
Принцип подвижного равновесия (принцип Ле - Шателье.)
Следует отметить, что уравнения изобары, а также изохоры являются частными количественными аналогами общего физико-химического правила называемого принцип подвижного равновесия (принцип Ле - Шателье.). Принцип формулируется следующим образом.
Если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий, определяющее состояние равновесия, то в системе усилится то из направлений процесса, протекание которого уменьшает эффект произведенного воздействия.
В общем случае принцип подвижного равновесия связан с оценкой величины работы процесса. Если dW=0 (или dН=0 при р= const), то процесс равновесный, в противном случае идет неравновесный процесс.
Характер неравновесного процесса можно раскрыть при анализе изобары. Действительно, уравнение (4.23) показывает, что градиент логарифма константы равновесия по температуре dlnKp/dtотрицательный для экзотермических реакций, но положительный для эндотермических реакций. Отрицательный градиент означает, что константа равновесия с увеличением температуры уменьшается. Это обстоятельство, в частности, объясняет, почему равновесие смещается в случае эндотермической реакции в сторону образования продуктов, а в случае экзотермической реакции в сторону образования реагентов.
ТИПОВОЙ ПРИМЕР
Известно, что константа равновесия реакции синтеза метилового спирта СО + 2 Н2 ↔ СН3ОН (г) при 298 К равна 4,13∙10-10 Па2, а тепловой эффект при 800 К равен DН(800 К) = -103,7 кДж. Рассчитайте константу равновесия реакции при 800 К.
Решение
Допустим, что в заданном диапазоне температур тепловой эффект не изменяется. В этом случае на основе уравнений изобары химической реакции, записанных для разных температур, можно получить
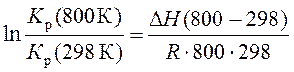 |
КОНТРОЛЬНОЕ ЗАДАНИЕ И ВОПРОСЫ
Выберите правильный ответ и обоснуйте его.
В случае эндотермической реакции Ст + Н2О(пар) = СО (газ) + Н2(газ), если одновременно уменьшить общее давление и повысить температуру в реакторе равновесие сместится в сторону:
а) образования продуктов реакции;
б) образования исходных веществ.
в) для ответа приведенной информации недостаточно.
1. Можно ли утверждать, что равновесное состояние, возникающее в реакционной системе, отличается от равновесного состояния нереагирующих веществ?
2. Почему химическое равновесие можно рассматривать как с позиций термодинамики, так и с позиций кинетики. Приведите кинетические и термодинамические условия химического равновесия.
3. Константа равновесия реакции H2+I2=2HI при 693 К равна 50. Будет ли происходить образование иодоводорода, если исходные концентрации H2=2 моль/л, I2-5 моль/л, HI-10 моль/л?
4. Как константа равновесия зависит от температуры? (Приведите анализ уравнения изобары).
5. Вычислите константу равновесия для реакции 3С2Н2(г)=С6Н6(г) протекающей пристандартных условиях, принимая, что газы идеальные.
6. При 30 oС степень диссоциации по реакции SO2Cl2= SO2 +Cl2 и общем давлении 5066,25 Па равна 0,2342. Вычислите К р (в СИ).
7. Как константа равновесия зависит от температуры?
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.