AlCl3
![]() C6H5 –H + CH3Сl 2 C6H5
–CH3 + HСl алкилирование по Фриделю-Крафтсу
C6H5 –H + CH3Сl 2 C6H5
–CH3 + HСl алкилирование по Фриделю-Крафтсу
H2SO4
![]() C6H5 –H + HONO2 C6H5
–NO2 + HOH нитрование
C6H5 –H + HONO2 C6H5
–NO2 + HOH нитрование
FeBr3
![]() C6H5 –H + H2 SO4 C6H5
–Br + HBr сульфирование
C6H5 –H + H2 SO4 C6H5
–Br + HBr сульфирование
FeBr3
![]() C6H5 –H + Br2 C6H5
–Br + HBr ацилирование
C6H5 –H + Br2 C6H5
–Br + HBr ацилирование
Механизм SE – реакций бензола:
1) активация реагента;
2) стадия электрофильной атаки;
3) образование П-аддукта;
4) образование σ-аддукта;
5) стадия отщепления протона.
Схема: быстро медленно
![]()
 + Е+ ↔
+ Е+ ↔  →Е+↔
→Е+↔
субстрат активная форма π-аддукт электрофила
 +1/3
Н +
+1/3
Н +
![]()
![]() ↔ +1/3
Е
↔ +1/3
Е →
→
 —Е + Н
—Е + Н
+1/3
σ –аддукт продукт реакции
1. Активация реагента. При образовании σ–аддукта происходит разрушение бензольного кольца, поэтому активировать кольцо может только сильный электрофил – либо катион X+, либо сильно поляризованная молекула X+Y-. Активация реагента осуществляется под действием катализатора, в качестве которого могут быть использованы – апротонные (кислоты Льюиса) и протонные кислоты (серная, азотная кислота).
2. Стадия электрофильной атаки. Эта стадия начинается с образования σ–аддукта, в котором реагент связывается с молекулой субстрата за счет π-электронов последнего. Π-аддукт – не химическое соединение, в котором частица электрофила связана ковалентной связью с каким либо конкретным атомом углерода бензольного кольца, это молекулярный комплекс, образующийся в результате донорно-акцепторного взаимодействия π-электронов с электрофилом, легко разлагающийся при нагревании или при действии воды. В π-аддукте π-электронная система кольца еще сохраняется. Далее электрофил вытягивает из π-электронного секстета электронную пару, образуя с ее помощью ковалентную связь с одним из атомов углерода, что приводит к возникновению карбокатиона - σ –аддукта (σ –комплекса).
Строение σ –аддукта. Атакуемый атом углерода, к которому присоединяется электрофил, переходит из sp2- в sp3 – гибридное состояние, образуя σ –связь. В образовавшемся карбокатионе присутствует сопряженная система связей, т.е. имеются условия для возникновения делокализованных пятицентровых МО, что приводит к делокализации положительного заряда. Делокализацию можно изобразить с помощью резонансных структур:
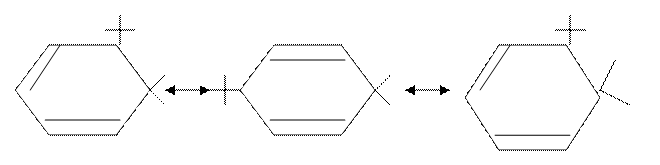
Положительный заряд распределен поровну между тремя (два орто- и одно пара- ) положениями относительно центра электронной атаки.
Благодаря делокализации положительного заряда σ–аддукт является довольно устойчивым карбокатионом.
3. Стадия отщепления протона. Дальнейшее превращение σ–аддукта может протекать в двух направлениях:
1) присоединение нуклеофила (энергетически невыгодно);
2) отщепление протона.
III.Заместители бензольного кольца и их влияние на скорость и направление реакции электрофильного замещения:
У незамещенного бензола атака направлена на любой из шести атомов углерода, т.к. все они равноценны. У замещенного бензола изменяется скорость реакции и электрофил атакует преимущественно определенные положения кольца по отношению к заместителю. Заместители бензольного кольца делятся на два типа:
· заместители I-го рода – орто-, пара-ориентанты. Это активирующие заместители, способствующие протеканию SE – реакций. Условия реакций – мягкие.
· заместители II -го рода – мета-ориентанты. Это дезактивирующие заместители, затрудняющие протекание SE – реакций. Условия реакций – более жесткие.
Реакции всегда протекают с большей скоростью в направлении образования более стабильного σ–аддукта.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.