4.4. Поведение газов при кристаллизации металлов и сплавов
Газы в металлах и сплавах в твердом и жидком состояниях образуют химические соединения: оксиды, нитриды, гидриды; растворы; а также могут находиться в молекулярной форме.
Молекулярная форма газов в отливках проявляется в виде газовых пор и раковин, т.е. несплошностей, снижающих механические свойства.
С позиций процесса кристаллизации особое значение имеет рассмотрение изменения растворимости газов при переходе металла из жидкого состояния в твердое. Для большинства металлов и сплавов, применяемых в технике, преимущественная роль в растворении принадлежит водороду и в меньшей степени азоту – для сплавов с высокими температурами плавления. В благородных металлах: серебре и золоте в больших количествах растворяется кислород.
Растворимость газов в металлических расплавах зависит от давления и для двухатомных газов подчиняется параболической зависимости:
![]() – закон Сивертса, где
– закон Сивертса, где ![]() – парциальное давление
двухатомного газа; k – некоторая константа, зависящая
от сплава, растворяемого газа и температуры; Сг –
концентрация растворенного газа.
– парциальное давление
двухатомного газа; k – некоторая константа, зависящая
от сплава, растворяемого газа и температуры; Сг –
концентрация растворенного газа.
Зависимость константы k от температуры представляют:
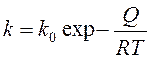 , где Q – теплота растворения газа; R – газовая постоянная; Т – абсолютная температура.
, где Q – теплота растворения газа; R – газовая постоянная; Т – абсолютная температура.
|
|
|
Рис. 69. Зависимость растворимости газа в металле от температуры |
Следует отметить, что представленная зависимость растворимости газа от температуры справедлива лишь для ограниченной области температур. При высоких температурах ~ свыше 1/2 Ткип – температуры кипения металла с ростом температуры происходит снижение растворимости, а при температуре кипения растворимость газа равна нулю (рис. 69).
Возрастание растворимости газа с ростом температуры на восходящей ветви кривой (рис. 69) обусловлено тем обстоятельством, что переходу газа в раствор металла в атомарном состоянии предшествует диссоциация молекулы газа в адсорбированном состоянии. А повышение температуры способствует ускорению диссоциации газовых молекул.
Для фазовых переходов в металлах и особенно для перехода из жидкого состояния в твердое наблюдается скачкообразное изменение растворимости газа. Как показано на рис. 69 при температуре затвердевания концентрация газа в жидком состоянии – Сг(ж) намного больше концентрации в твердом состоянии Сг(тв). В табл. 11 приведены количественные величины растворимости водорода в наиболее распространенных металлах при температуре кристаллизации.
Таблица 11
Растворимость водорода в металлах при температуре кристаллизации
|
Металл |
Температура кристаллизации, °С |
Концентрация водорода, см3/100 г |
|
|
твердый |
жидкий |
||
|
железо |
1537 |
13,3 |
26,6 |
|
алюминий |
660 |
0,036 |
0,690 |
|
медь |
1083 |
4,0 |
12,0 |
|
магний |
650 |
18,0 |
26,0 |
Анализируя данные таблицы, можно видеть, что по аналогии с ликвационными процессами при кристаллизации происходит перераспределение растворенного газа, и соответственно способность металлов к образованию газовых раковин и газовых пор можно оценивать по величине коэффициента распределения газа и абсолютным величинам растворимости. Так известный факт большой склонности меди к газовым раковинам при литье хорошо объясняется данными табл. 11. Если в процессе плавки меди насыщение водородом произошло до максимального предела – 12 см3/100 г и в процессе кристаллизации разность в растворимости газов осуществилась в газовых раковинах и порах, то 8 см3/100 г будет выглядеть как 8 см3 газовых пор на 12,5 см3 объема меди.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.