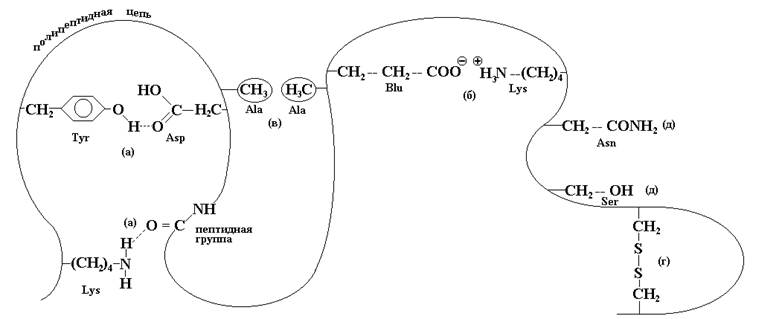
К основным видам связи, фиксирующим третичную структуру, относятся водородные связи (а), ионные или эктростатические (б), гидрофобное взаимодействия неполярных радикалов (в), дисульфидные ковалентные связи (г), возникающие между пространственно сближенными остатками цистеина, а также наличием гидратируемых групп (д), которые окружены молекулами воды, способным при определенных условиях образовывать структуру, подобную структуре льда. Этот водный слой также определяет структурную стабильность белковой молекулы.
Образование дисульфидной связи – окислительно-восстановительный процесс, связанный с переносом электронов и протонов:
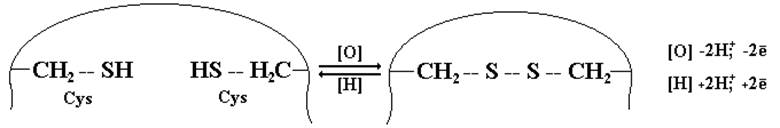
Дисульфидная связь содержится в очень многих пептидах и белках (окситоцин, вазопрессин, инсулин, кератин и др.) и имеет большое значение для фиксации третичной структуры белковой молекулы.
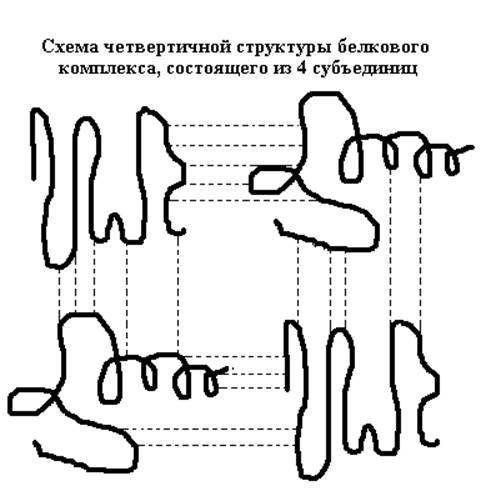
Первичная, вторичная и третичная структуры – три уровня структурной организации всех белковых молекул. Четвертый уровень встречается при образовании единых белковых комплексов, состоящих из нескольких полипептидных цепей. При этом каждая цепь, сохраняя характерные для нее первичную, вторичную и третичную структуры, выступает в роли субъединицы комплекса с более высоким уровнем пространственной организации – четвертичной структуры. Такой комплекс представляет собой единое целое и выполняет биологическую функцию, не свойственную отдельно взятым субъединицам. Фиксируют такой комплекс водородные связи и гидрофобные взаимодействия между субъединицами.
Так, например, четвертичная структура гемоглобина (основного компонента эритроцитов) представляет собой образование из четырех полипептидных цепей (субъединиц) – тетрамер, ведущий себя в растворе как единая молекула.
Белки можно разделить на две большие группы: простые и сложные. Простые белки гидролизуются до аминокислот, но при этом не дают других органических или неорганических соединений.
Сложные белки (нуклеопротеиды, липопротеиды, гликопротеиды, гемопротеиды, металлопротеиды, флавопротеиды) – при гидролизе дают не только аминокислоты, но также и другие органические и неорганические соединения; в некоторых случаях эти соединения называют простетической группой.
Исторически сложилось также разделение белков на глобулярные и фибриллярные. Для глобулярных белков более характерна a-спиральная структура. Пептидные цепи глобулярных белков компактно свернуты. Все или почти все полярные группы глобулярных белков расположены на поверхности молекулы и гидратированы, гидрофобные остатки находятся внутри молекулы. Благодаря такому строению глобулярные белки растворяются в воде и солевых растворах. Примерами глобулярных белков являются: альбумин (яичный белок),почти все ферменты, глобин (белковая часть гемоглобина), миоглобин.
Для фибриллярных белков более характерна b-структура. Как правило, они имеют волокнистое строение, в воде не растворяются. К ним относятся b-кератин (волосы, роговая ткань), b-фибрин шелка, миоинозин (мускульная ткань), коллаген (соединительная ткань).
Пространственная структура белков способна нарушаться под влиянием ряда факторов: повышенной температуры, изменения кислотности среды, облучения УФ- или рентгеновскими лучами и т.д.
Денатурацией называют разрушение нативной (природной) макроструктуры белка. Первичная структура белка при денатурации сохраняется.
Денатурация может быть обратимой, если после прекращения воздействия происходит ренатурация (восстановление) изменения в структуре, и необратимой, часто происходящей, например, при тепловом воздействии.
У денатурированных белков исчезает биологическая активность, определяемая в основном третичной структурой белковой молекулы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.