Этот простой и в то же время необыкновенно продуктивный принцип обеспечивает практически все многообразие проявлений жизни на нашей планете. Все живое – от амеб до слонов, от вируса гриппа до человека – имеет основой структуры и функций белковые молекулы, построенные из двадцати аминокислот. Таким образом, эти двадцать аминокислот – универсальная азбука всего живого.
Белковую (полипептидную) молекулу формально можно представить как продукт поликонденсации более 100 a-аминокислот, протекающей с образованием пептидной (амидной) связи межу мономерными звеньями:
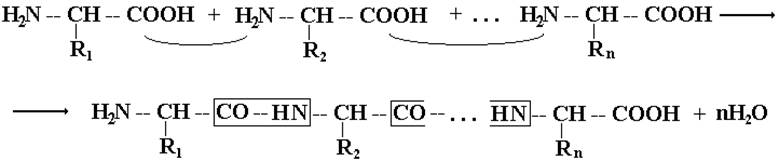
a-Аминокислоты в молекуле белка соединены не хаотично, а в строгом соответствии с кодом белкового синтеза.
При единообразно построенной полиамидной цепи специфичность белков определяется двумя важнейшими характеристиками – аминокислотным составом и аминокислотной последовательностью.
Аминокислотный состав – это природа и количественное соотношение входящих в белковую молекулу a-аминокислот.
Аминокислотный состав определяется путем анализа смеси аминокислот, получаемых в результате полного гидролиза белка в условиях кислого катализа. Как правило, белки имеют гетерогенный состав, однако, в редких случаях может преобладать какая-нибудь одно a-аминокислота.
Аминокислотная последовательность, то есть порядок чередования a-аминокислотных остатков составляет первичную структуру белка.
Первичная структура белка определяется путем последовательного отщепления a-аминокислот с какого-либо конца цепи и их идентификации.
Расшифрована первичная структура около 1000 разных белков, однако, это число ничтожно мало, если учесть, что в природе имеется около 1012 разнообразных белковых молекул.
Первичная структура, то есть природа a-аминокислотных остатков и порядок их соединения, обуславливает характер стабилизации более высокоорганизованных структур белка – вторичной и третичной.
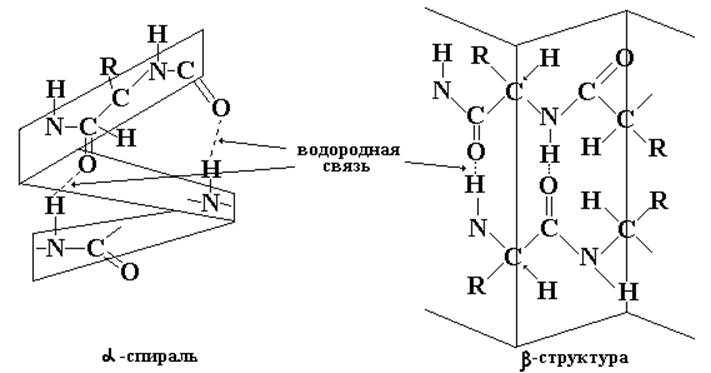
Вторичная структура. Описывается пространственной ориентацией (конформацией) основной полипептидной цепи фиксируемо водородными связями между пептидными группами.
Принимая во внимание плоское строение пептидной связи, возможность свободного вращения связей у a-углеродного атома, постоянства углов и межатомных расстояний, можно прийти к двум основным моделям вторичной структуры.
Первая – этоa-спираль (правая или левая), которую можно себе представить в виде петидной цепи, закрученной вокруг воображаемого цилиндра. Эта вторичная структура стабилизируется водородными связями, которые возникают между аминокислотными звеньями пептидной цепи. Степень спирализации в белках колеблется от 5 до 80%.
Вторая возможная структура – это структура типа складчатого слоя (b-структура), в которой полипептидные цепи лежат антипараллельно (или параллельно) друг другу, и водородные связи соединяют две различные пептидные цепи.
Оставшаяся часть молекулы белка, не включенная в a-спираль и b-слои, образует беспорядочный клубок.
Третичная структура белка – суммарная конформация отдельных участков полипептидной цепи, трехмерная архитектура всей белковой молекулы. Основные виды взаимодействий, фиксирующих третичную структуру белковой молекулы, обусловлены взаимодействием боковых радикалов a-аминокислотных остатков, находящихся в линейной полипептидной цепи на значительной удалении друг от друга, но сближенных в пространстве за счет изгибов цепи.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.