Пептиды. Белки.
· четыре уровня организации молекулы;
· конформация молекулы, ее лабильность при взаимодействии с компонентами среды (водой, липидами и др.).
· растворимость и набухание;
· осаждение (денатурация и высаливание);
· электрофорез;
· осмотическое давление;
· вязкость;
· лиофилизация;
· гидролиз.
Пептиды. Каскадный синтез дипептида.
Все рассмотренные выше метаболические процессы, происходящие с a-аминокислотами, а также бесконечное множество не рассмотренных превращений этих важнейших молекул, составляющих предмет изучения в курсе биохимии, хоть и являются жизненно важными, но все же представляют собой как бы вторые профессии a-аминокислот. Главная и основная их особенность – способность конденсироваться друг с другом, образуя макромолекулы пептидов и белков.
Условно считают, что пептиды соединяют в молекуле до 100, а белки – выше 100 аминокислотных остатков.
Пептидную или белковую макромолекулу формально легко представить как продукт поликонденсации a-аминокислот, протекающей с образованием пептидной связи между мономерными звеньями:
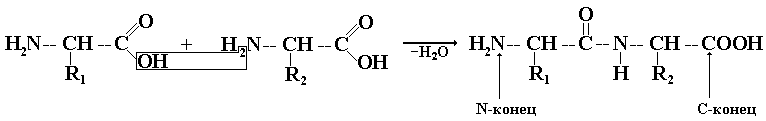
Если соединяются две молекулы a-аминокислот, то образуется молекула дипептида, если три – молекула трипептида и т.д., наконец, при большом количестве соединенных a-аминокислотных звеньев говорят о полипептидах. Но сколько бы аминокислот не входило в состав макромолекулы, в ней всегда различают N-конец (по свободной концевой NH2-группе) и С-конец (по свободной концевой СООН-группе). Конструкция полипептидной цепи одинакова для всего разнообразия пептидов и белков – эта цепь имеет неразветвленное строение.
Название пептида складывается из трехбуквенных обозначений входящих в него a-аминокислот. При формировании полного названия начинают перечислять последовательность аминокислот с N-конца макромолекулы с изменением окончания на -ил тех аминокислот, которые участвуют в образовании пептидной связи своей карбоксильной группой, название же последней аминокислоты, имеющей свободную концевую СООН-группу (на С-конце) сохраняет без изменения.
Например, трипептид Ала-Фен-Вал,
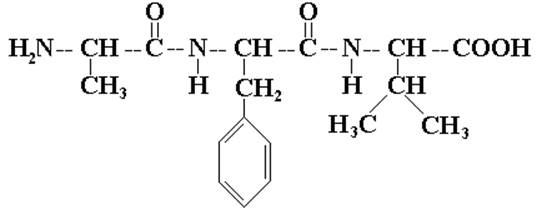 , имеет полное название Аланил-Фенилаланил-Валин.
, имеет полное название Аланил-Фенилаланил-Валин.
Электронное строение пептидной связи.
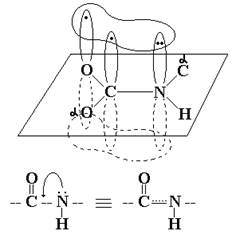 Связь С-N носит в значительной степени характер двойной связи
вследствие сопряжения неподеленной пары электронов атома азота с p-электронами двойной связи. Ее длина 1,32 Å,
что значительно меньше длины обычной одинарной связи (1,53 Å), но больше двойной
(1,27 Å).
Связь С-N носит в значительной степени характер двойной связи
вследствие сопряжения неподеленной пары электронов атома азота с p-электронами двойной связи. Ее длина 1,32 Å,
что значительно меньше длины обычной одинарной связи (1,53 Å), но больше двойной
(1,27 Å).
Благодаря
образованию трехцентровой сопряженной системы с делокализацией общего p-электронного облака пептидная связь
является планарной (плоской), а вращение вокруг связи ![]() становится запрещенным. Сα-атомы,
примыкающие с двух сторон к одной пептидной группе, обычно находятся в
транс-положении по отношению друг к другу. Сα-атом связан одинарными
связями с N-атомом одной пептидной группы и с С-атомом
следующей. Вокруг этих одинарных связей возможно относительно свободное вращение:
становится запрещенным. Сα-атомы,
примыкающие с двух сторон к одной пептидной группе, обычно находятся в
транс-положении по отношению друг к другу. Сα-атом связан одинарными
связями с N-атомом одной пептидной группы и с С-атомом
следующей. Вокруг этих одинарных связей возможно относительно свободное вращение:
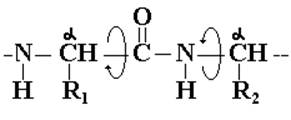
В пептидной группе возможна прототропная лактим-лактамная таутомерия:

Пептиды играют важную роль в работе нервной системы человека и животных. В последнее десятилетие было доказано, что они служат важным средством «общения» между собой нервных клеток, наравне с давно известными медиаторами – дофамином, норадреналином, ацетилхолином. Пептиды смело можно назвать вездесущими работниками центральной нервной системы. Во всем мире сейчас идут широкие исследования пептидов, регулирующих состояние голода, жажды, боли, агрессии, страха. Многие из них работают в «системе удовольствия» или «системе положительного подкрепления», моделируя проведение нервных импульсов по тем нервным путям, которые создают чувство радости, веселья, обезболивания. К последним, например, относятся так называемые опиоидные нейропептиды – энкефалины и эндорфины, которые образуются в мозге и оказывают на ЦНС действие, сходное с действием морфина. Однако к ним не возникает наркотического привыкания, о чем свидетельствует их физиологически управляемый биосинтез. И до сих пор остается загадкой, каким образом организм не попадает в расставленную себе самому ловушку. Нейропептиды – пентапептиды, например, Тир-Гли-Гли-Фен-Мет (мет-энкефалин) и Тир-Гли-Гли-Фен-Лей (лей-энкефалин) – относятся именно к таким пептидам.
Некоторые пептиды проявляют антибактериальное действие и используются как лекарственные средства, например, грамицидин С – циклический декапептид. Большое значение имеет группа пептидов, обладающих гормональным действием, например, инсулин, с недостатком которого в организме связаны серьезные нарушения углеводного обмена, на расшифровку строения молекулы которого ушло 10 лет. Большие надежды, особенно у нерадивых студентов, может пробудить вазопрессин, вырабатываемый задней долей гипофиза и регулирующий минеральный обмен и баланс жидкости, так как в последнее время установлено, что он относится к числу мощных стимуляторов запоминания.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.