Помимо изучения строения и функций, синтезируемых клеткой пептидов и белков, уже 100 лет назад умы ученых занимала весьма широкая мировоззренческая проблема: можно ли воссоздать «живое вещество», получив белок искусственным путем, поскольку уже тогда было ясно, что любые проявления жизни так или иначе связаны с деятельностью белковых соединений. В то время казалось, что искусственное воспроизведение белка будет означать возникновение «жизни в пробирке». Геккель, крупнейший немецкий естествоиспытатель конца XIX века, слегка иронично заметил: «Когда вы, химики, создадите истинный белок, то он закопошится!»
Что ж, химики создали истинные белковые и пептидные молекулы, и они действительно «закопошились» - проявили биологическую активность. Например, инсулин, в первых работах по искусственному синтезу которого принимал участие профессор К.А. Макаров, ныне заведующий нашей кафедрой. Синтез инсулина длился три года и насчитывал 223 химические реакции. И хотя выход готового продукта составлял всего несколько миллиграммов, это было начало большого пути.
Химические основы получения пептидов рассмотрим на примере синтеза дипептида Аланилвалина (Ала-Вал). Этот вид синтеза, состоящий из последовательно проводимых химических взаимодействий, получил название каскадного синтеза.
Итак, требуемый дипептид
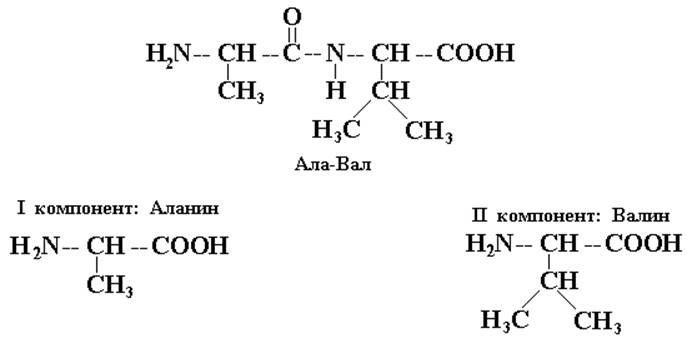
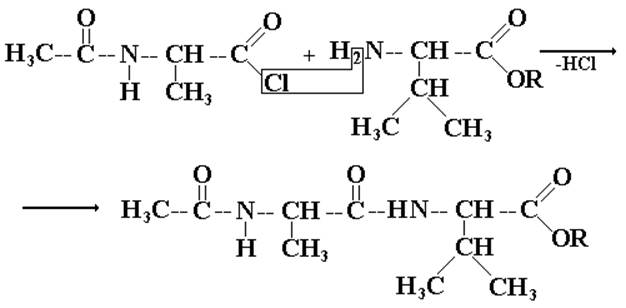
Для получения заданной последовательности необходимо, чтобы прошла реакция между СООН-группой аланина и NH2-группой валина, но при этом исключить возможность взаимодействия других концевых групп, т.к. это приведет к циклическому соединению – дикетопиперазину. С этой целью используют так называемые операции «защиты» концевых групп. В качестве «защитных» может быть использована любая обратимая реакция на данную функциональную группу.
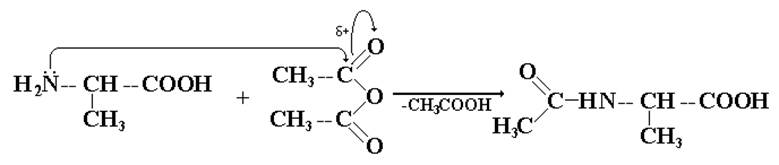
I. «Защита» концевой NH2-группы первого компонента.
Использую нуклеофильный характер NH2-группы, проводят реакцию с ацелирующими агентами, например, ангидридом уксусной кислоты:
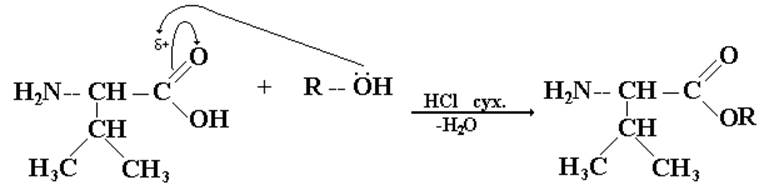
II. «Защита» концевой СООН-группы второго компонента.
Здесь используется реакция этерификации, проводимая в условиях, исключающих обратимость:
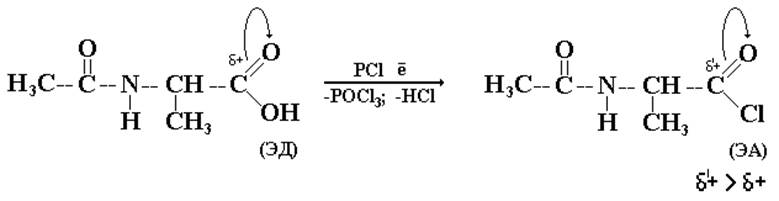
III. Активация СООН-группы первого компонента.
Еще одна подготовительная операция с целью придать большую реакционную способность одному из реакционных партнеров. Это удается сделать, усилив электронодефицитность атома углерода карбоксильной группы первого компонента путем получения галогенангидрида по известной реакции:
IV. Непосредственно – синтез.
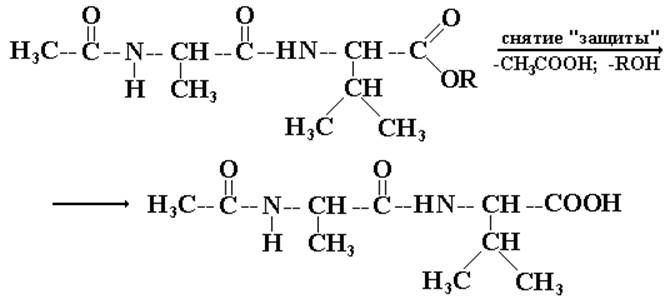
V. Снятие «защиты».
Очень сложные и тонкие реакции снятия «защиты» должны проводиться так, чтобы не разрушить образованной пептидной связи. Схематично их можно обозначить общим термином «снятие защиты».
Белковые молекулы представляют собой неразветвленные полимерные цепи, построенные из L-a-аминокислот.
Напомним, что макромолекулы любого полимера состоят из большого числа мономерных звеньев. В пептидах и белках такими мономерными звеньями, элементарными «кирпичиками» являются 20 a-аминокислот, обязательный набор белковых макромолекул. Представим себе полимер, состоящий из одинаковых звеньев, например, полиэтилен. Он состоит из связанных друг с другом одинаковых молекул этилена. Если этилен обозначить буквой «э», то звуковое выражение полиэтилена проявится монотонным и однообразным звуком «э-э-э-э-э-э-э» весьма ограниченной возможностью передачи информации. Если же для построения макромолекулы 20 «букв» - аминокислот, то их перестановка в среднем белке длинною в 500 мономеров дает астрономическую величину 20500 вариантов полимера.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.