К началу II мировой войны в ряде иностранных армий были разработаны более совершенные средства боевого применения этого ОВ, позволяющие создавать в приземном слое атмосферы концентрации паров HCN, которые могут вызвать гибель незащищенной живой силы в течение нескольких секунд. Усовершенствование противогазов, а так-же появление ФОВ снизили военное значение HCN. Тем не менее ее и в настоящее время следует относить к потенциальным боевым отравляющим веществам в связи с широкомасштабным применением во всех индустриально-развитых странах для мирных целей.
Основными областями потребления HCN являются производство органического стекла, акрилонитрила (синтез каучука и искусственных волокон), металлургия (обогащение руд и комплексообразователей), синтез аминокислот. Сама синильная кислота используется как фумигант для окуривания цитрусовых и оливковых деревьев, уничтожения насекомых и грызунов в зернохранилищах, на железнодорожных складах, на морских судах. Ежегодные производства HCN превышают 300 тыс. тонн, из которых 200 тыс. тонн приходится на США.
В Вооруженных Силах США синильной кислотой снаряжены 1000-фунтовые авиационные химические бомбы взрывного типа действия.
Синильная кислота HCN – цианистый водород, цианистоводородная кислота – бесцветная прозрачная жидкость с запахом горького миндаля (в малых концентрациях). Характерный запах ощущается при концентрации в воздухе 0,009 мг/л.
Tкип + 25,7 С, Тзам – 13,4 С. Относительная плотность паров по воздуху равна 0,93.
Синильная кислота во всех соотношениях смешивается с водой и растворяется в большинстве органических растворителей. Парообразная синильная кислота плохо поглощается активированным углем, но легко сорбируется другими пористыми материалами: резиново-техническими изделиями, шерстяными, текстильными тканями, кожаными материалами. При этом масса поглощенного ОВ составляет до 0,1% от массы пористого материала. При проветривании десорбируется лишь около 75% поглощенной синильной кислоты.
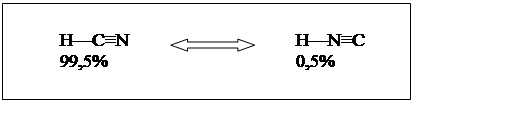 |
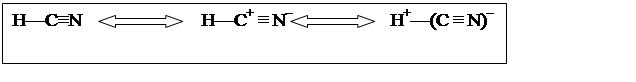
Синильная кислота является простейшим представителем класса нитрилов, химические свойства определяются в основном полярной группой – С+ = N– с частично положительным зарядом на атоме углерода и частичным отрицательным на азоте. Некоторые особенности ее свойств обусловлены тем, что атом углерода соединен не с углеводородным радикалом, как у всех нитрилов, а с атомом водорода.
Электронное строение синильной кислоты:
 |
Гидролиз HCN протекает очень медленно, сначала до формамида, который затем превращается в аммониевую соль муравьиной кислоты.
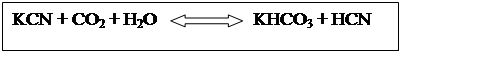
Водными растворами аммиака, имеющими рН > 10, HCN гидролизуется до формиата аммония. В менее основных растворах HCN полимеризуется. Аналогично ведет себя HCN с растворами щелочей: концентрированные щелочи превращают ее в токсичные цианистые соли, а разбавленные -в полимеры.
 |
Синильная кислота и ее соли взаимодействуют с коллоидной серой или веществами, ее выделяющими, образуя нетоксичные роданиды:
 |
При обработке синильной кислоты галоидами или галоидирующими средствами (хлораминами, гипохлоритами, бромамидами) получаются токсичные галоидангидриды:
 |
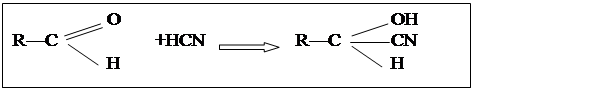
Взаимодействуя с альдегидами и кетонами (сахара) синильная кислота и ее соли образуют малотоксичные циангидрины:
Эта реакция лежит в основе детоксикации яда
 |
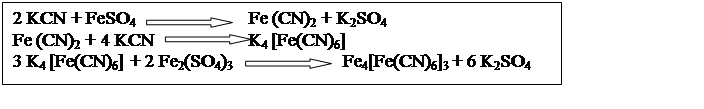 |
Кислородом воздуха синильная кислота не окисляется, но будучи подожжена – хорошо горит. Жидкая синильная кислота при детонации взрывается, подобно нитроглицирину.
Хлорциан – бесцветная жидкость с резким раздражающим запахом хлора.
Tкип + 12,6 С, Тзам – 6,5 С. Относительная плотность паров по воздуху равна 2,1.
Раздражающее действие на глаза и органы дыхания проявляются без периода скрытого действия. Начальная раздражающая концентрация – 0,002 мг/л, непереносимая, вызывающая обильное слезотечение и спазм век – 0,06 мг/л. Концентрация 0,4 мг/л при экспозиции 10 мин может вызвать смертельный исход.
Относительная токсичность при ингаляционном воздействии ICt50 = 11 мг х мин/л, при этом смерть может наступить в течение 1–15 мин.
Бромциан – бесцветное или желтое кристаллическое вещество, очень летучее, с резким запахом.
Tкип + 61,3 С, Тпл + 52,5 С. Относительная плотность паров по воздуху равна 3,2. По токсичности близок к хлорциану.
Сероводород – бесцветный газ с характерным запахом тухлых яиц. Тяжелее воздуха. В концентрации 0,006 мг/л вызывает жжение в глазах, головную боль, слезотечение, светобоязнь, насморк. При концентрации 0,2 – 0,3 мг/л – боль в глазах, полнокровие конъюнктивы, раздражение слизистой носоглотки, зева, металлический вкус во рту, утомляемость, головную боль, стеснение в груди, тошноту, рвоту, резкую слабость, головокружение, обморочное состояние или возбуждение с помрачением сознания.
Частота дыхания вначале замедляется, затем учащается, дыхание становится поверхностным. Продолжение ингаляции приводит к развитию токсического отека легких.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.