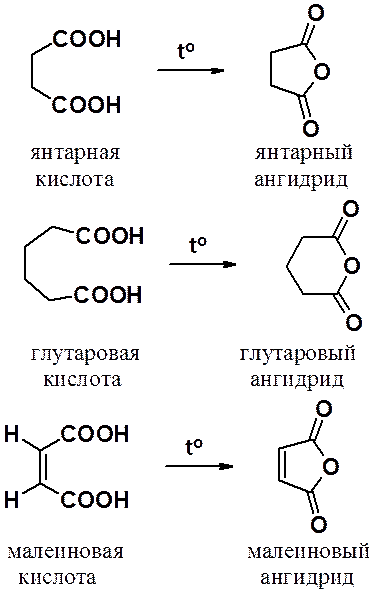
Малеиновый ангидрид – классический диенофил в реакциях Дильса-Альдера. Глутаровый и янтарный ангидриды используют для проведения реакций ацилирования. При этом, в ацильной группе продукта ацилирования сохраняется одна карбокси-группа.
Янтарный ангидрид используется для получения имида, а затем его бромпоизводного. Бромсукцинимид (N-бромимид янтарной кислоты), способен создавать и поддерживать в реакционной смеси низкую концентрацию атомарного брома, поэтому его используют для введения в органические соединения брома по свободнорадикальному механизму, например для бромирования в аллильное положение.
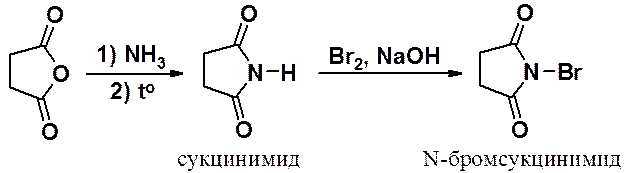
Щавелевая и малоновая кислоты при нагревании претерпевают декарбоксилирование.
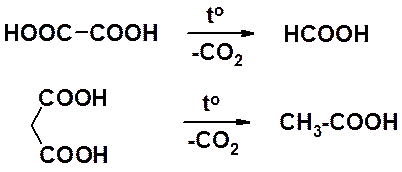
Высушивание щавелевой кислоты в сушильном шкафу является грубейшим нарушением правил техники безопасности. Декарбоксилирование щавелевой кислоты проходит при температуре ниже 100о, и образующаяся муравьиная кислота переходит в пар. Вдыхание паров муравьиной кислоты чрезвычайно опасно.
Малоновая кислота претерпевает декарбоксилирование в очень мягких условиях, при нагревании примерно до 60о. Легкость декарбоксилирования малоновой кислоты определяет широкое применение в органическом синтезе ее производных в органическом синтезе. Чаще всего используют диэтилмалонат (диэтиловый эфир малоновой кислоты), который обычно именуют просто «малоновый эфир».
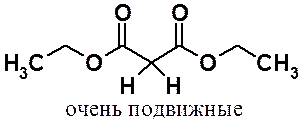
Акцепторные сложноэфирные группы стягивают к себе электронную плотность. Протоны метиленовой группы оказываются позитивированными и могут легко быть отданы подходящему основанию. Кроме того, образующийся анион – стабилизирован за счет сопряжения, шесть электронов распределены по трем атомом углерода и двум электроноакцепторным атомам кислорода, что увеличивает его устойчивость.
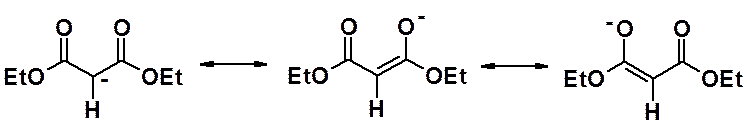
Малоновый эфир проявляет свойства СН-кислоты, но только в неводной среде.
Именно кислые свойства малонового эфира используются в синтезе. Реакцией малонового эфира с металлическим натрием в абсолютных апротонных растворителях или с этилатом натрия в этаноле получают натрмалоновый эфир.
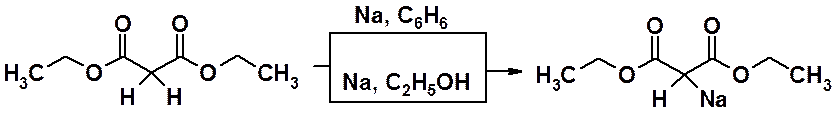
Связь углерод-натрий сильно полярная (почти ионная), поэтому натрмалоновый эфир проявляет выраженные нуколеофильные свойства и часто используется в реакциях нуклеофильного замещения. С его помощью проводят замещение галогена, а затем, используя легкость декарбоксилирования малоновой кислоты, получают монокарбоновую кислоту. Таким образом, удается получить карбоновую кислоту, в которой на два атома углерода больше, чем содержалось в исходном галогенопроизводном.
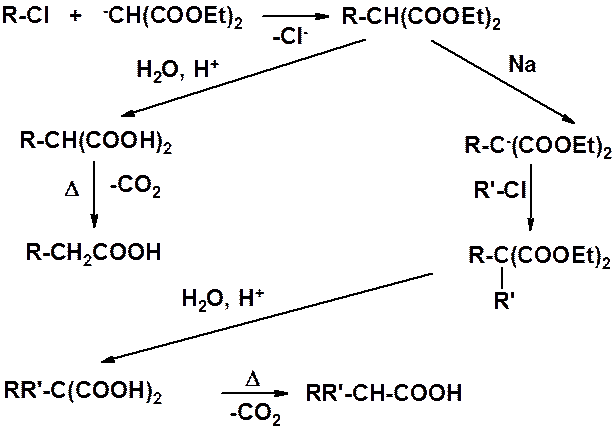
После алкилирования малонового эфира можно повторить реакцию: за счет второго водорода метиленового звена получить еще одно натровое производное, затем провести алкилирование, после чего гидролиз и декарбоксилирование. В этом случает, полученная карбоновая кислота имеет разветвление в b-положении.
Некоторые синтетические возможности малонового эфира показаны ниже.
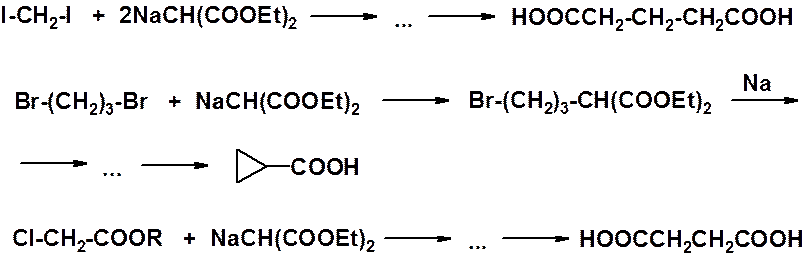
Среди ароматических дикарбоновых кислот наибольшее значение имеют фталевая и терефталевая. Фталевую кислоту, виде ее ангидрида, получают окислением нафталина в, терефталевую – окислением пара-ксилола.
Фталевую кислоту в синтезе обычно используют в виде ангидрида, который применяют для получения фталимида, с помощью которого получают очень чистые первичные амина (см. раздел «Амины»).

Эфиры фталевой кислоты используют в качестве пластификаторов, а также репеллентов.
Конденсацией фталевого ангидрида с глицерином получают глифталевые смолы, используемы при производстве лаков и красок. Сначала получают термопластичный линейный полимер с одной свободной ОН-группой глицеринового фрагмента.
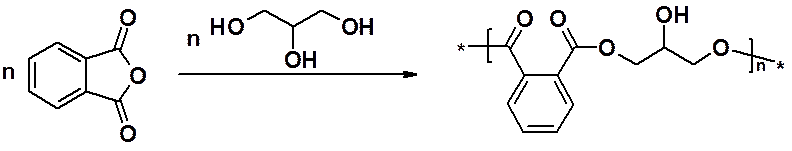
На воздухе эта гидроксильная группа вступает в реакцию межмолекулярной дегидратации, образуя трехмерный очень прочный и устойчивый к механическим и атмосферным воздействиям полимер.
Переэтерификация с одновременной поликонденсацией диметилового эфира терефталевой кислоты с этиленгликолем приводит к полиэфиру. Последний перерабывают, получая синтетический материал, известный у нас под названием «полиэстер».
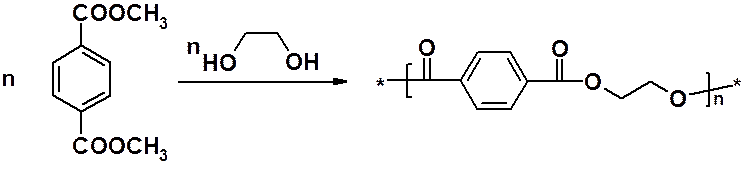
· Химические свойства. Кислотность и образование солей. Десульфирование, реакции нуклеофильного замещения сульфогруппы (щелочное плавление, получение нитрилов). Получение и свойства функциональных производных сульфокислот: сульфохлоридов, сульфамидов, эфиров. Сульфаниламидные препараты (стрептоцид, сульфидин и др.).
Нитросоединения.
· Классификация, изомерия, номенклатура. Строение нитрогруппы и ее влияние на углеводородные радикалы. Физические свойства и спектральные характеристики нитросоединений.
· Методы получения нитросоединений: прямое нитрование углеводородов, замещение галогена на нитрогруппу, через соли диазония. Введение нитрогруппы в бензольное ядро и боковую цепь, нитрующие агенты. Условия реакции нитрования и механизм. Ион нитрония, условия его образования, электронное и геометрическое строение. Строение нитрогруппы и ее влияние на углеводородные радикалы.
Методы получения сульфокислот алифатического и ароматического рядов рассмотрены в соответствующих разделах, а реакция щелочного плавления сульфокислот – в разделе «Фенолы».
Сплавлением ароматических сульфокислот с солями синильной кислоты получают ароматические интрилы.
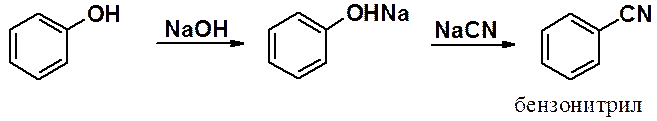
Большое значение имеют не сами сульфокислоты, а их производные (в первую очередь ароматического ряда) – эфиры и амиды сульфокислот. Алифатические сульфокислоты используют как компонент СМС.
Строение сульфогруппы:
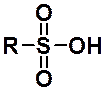
Сульфокислоты обладают большей кислотностью, чем соответствующие карбоновые. Замещение ОН-группы на нуклеофильный остаток в сульфокислотах затруднено. Поэтому их производные получают не из самих сульфокислот, а из сульфонилхлоридов (сульфохлоридов), которые можно рассматривать как хлорангидриды сульфокислот.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.