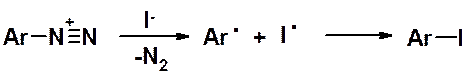
Как было отмечено выше, соли диазония в твердом виде взрывоопасны. Этот вывод не относится к солям тетрафторобороводородной кислоты (HBF4), которые устойчивы неограниченное время. Обычно их получают обработкой раствора хлорида диазония раствором тетрафторбората натрия. Тетрафторбораты диазония, как правило, обладают очень низкой растворимостью в воде, что сдвигает равновесный процесс обмена аниона вправо, и позволяет количественно получать тетрафторбораты диазония.

Термическое разложение по гетеролитическому механизму тетрафторборатов диазония приводит к фтораренам.
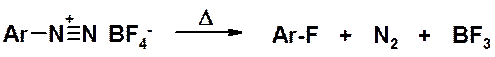
В присутствии солей одновалентной меди соли диазония превращаются в ароматические нитро- и цианопроизводные.
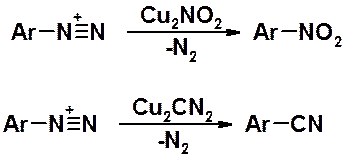
Результат восстановления солей диазония – арилгидразины.
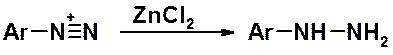
Это важная группа реакций SEAr, приводящая к азосоединением, среди которых очень много широко применяемых красителей.
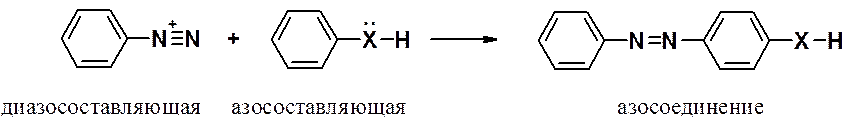
Диазосоставляющая в реакции – соль диазония, которая является электрофилом в реакции ароматического электрофильного замещения. Поскольку соль диазония – очень слабый электрофил, к строению азосоставляющей предъявляются существенные требования. Реакция азосочетания возможна только в том случае, когда азосоставляющая: первичный ароматический (Ar-NH2), вторичный (Ar-NH-Alk) или третичный (Ar-N-Alk2) жирноароматический амин или фенол (Ar-OH). В некоторых случаях реакция идет и с алкиловыми эфирами фенолов (Ar-O-Alk). Таким образом, азосоставляющая должна иметь в ароматическом кольце наиболее сильные активирующие заметители.
Реакция идет исключительно в пара-положение азосоставляющей. Если оно занято COOH- или SO3H-группами, то происходит их замещение. Если в пара-положении расположены другие группировки – реакция идет в положение 2 (рядом с донором).
Классический синтез азосоединения – получение метилового оранжевого (красителя и индикатора).
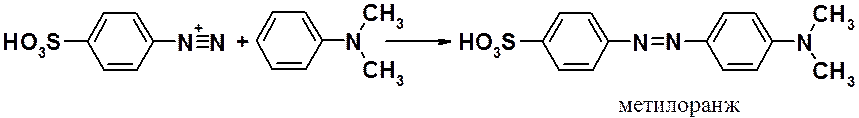 Недостаточно просто смешать
подходящие по реакционной способности диаза- и азасоставляющие. Следует
учитывать, что соли диазония получают в кислом водном растворе, в котором очень
легко происходит замещение диазагруппы на гидроксил. Поэтому азосоединение
может быть загрязнено, образовавшимся в результате конкурентной реакции
фенолом.
Недостаточно просто смешать
подходящие по реакционной способности диаза- и азасоставляющие. Следует
учитывать, что соли диазония получают в кислом водном растворе, в котором очень
легко происходит замещение диазагруппы на гидроксил. Поэтому азосоединение
может быть загрязнено, образовавшимся в результате конкурентной реакции
фенолом.
В основной среде соль диазония превращается в диазокислоту и ее соль, которые не обладают электрофильными свойствами и не могут вступать в азосочетание.
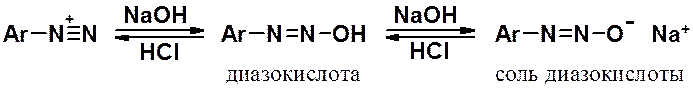
Щелочная среда уменьшает реакционную способность диазосоставляющей, а кислая - увеличивает.
Амины в кислой среде превращаются в аммонийные соли. NH3+-Группа обладает сильными электроноакцепторным свойствами и азосоставляющая в кислой среде теряет способность участвовать в азосочетании.
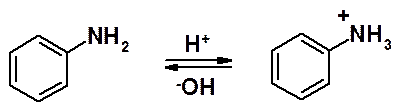
Фенолы проявляют наибольшую активность в щелочной среде, превращаясь в феноляты.
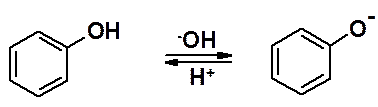
Таким образом, активность диазосоставляющей максимальная в кислой среде, азосоставляющей – в щелочной.
На практике, реакции солей диазония с аминами проводят в слабокислой среде, с фенолами – в слабощелочной.
· Общие представления и классификация. Число звеньев, типы и число гетероатомов, номенклатура, макроциклы. Гетероароматические соединения. Азины и азолы. Концепция p-избыточности и p-дефицитности.
· Фуран, пиррол, тиофен. Общая характеристика строения. Диеновый и ароматический характер этих соединений. p-Избыточность. Зависимость степени ароматичности от природы гетероатома и ее влияние на химические свойства. Понятие о пиррольном атоме азота. Получение фурана, пиррол, тиофен и их гомологов. Взаимопревращения фурана, пиррола и тиофена по Юрьеву.
Гетероциклическими называют органические соединения циклического строения, в построении циклов которых принимают участие атом (или атомы) отличный от углерода. В роли гетероатома может выступать любой элемент, способный образовать две (или более) ковалентных связи. В настоящее время получены гетероциклы почти со всеми возможными элементами периодической системы, но наибольшее значение в качестве гетероатомов имеют сера, кислород и особенно азот. Такие соединения и будут рассмотрены далее.
Гетероциклические соединения делят на три большие группы: предельные, непредельные, обладающие ароматическими свойствами (гетероароматические).
Внутри каждой группы гетероциклы классифицируют по размеру цикла, числу и способу связывания колец, числу и типу гетероатомов.
Гетероциклические соединения один из важнейших классов органических веществ. Именно их исследованиям посвящены специальные журналы (Heterocycles, Chemistry of Heterocyclic Compounds и др.), тогда как специальные журналы, посвященные другим классам ароматических соединений, отсутствуют. Это вызвано огромной ролью, которую играют гетероциклы в процессах жизнедеятельности. Среди них много веществ обладающих биологической активностью. Именно гетероциклы входят в состав нуклеиновых кислот. Большинство лекарственных веществ относятся к этому классу органических соединений.
Достаточно несколько примеров. К гетероциклическим соединениям относятся: хлорофилл, гем, пенициллин, многие витамины (тиамин – В1), яды (никотин) и наркотические вещества (морфин) и т.д. и т.п.
С точки зрения получения и химических свойств насыщенные и ненасыщенные гетероциклы не представляют особого интереса.
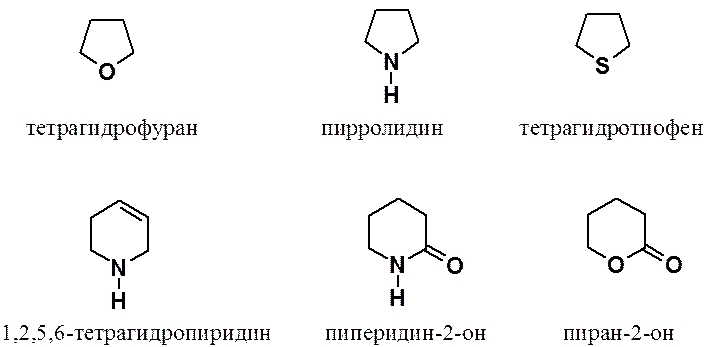
Тетрагидрофуран, пирролидин и тетрагидротиофен проявляют типичные свойства простых эфиров, вторичных аминов и сульфидов соответственно.
1,2,5,6-Тетрагидропиридин – типичный алкен, содержащий в молекуле вторичную аминогруппу, пиперидин-2-он – амид (циклический амид – лактам), а пиран-2-он – сложный эфир (циклический сложный эфир – лактон).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.