
Ацидофобность фурана делает практически невозможным проведение с ним реакций в кислой среде.
Несколько меньшую ацидофобность проявляет пиррол. Тиофен абсолютно неацидофобное вещество. Пара электронов атома серы, участвующая в сопряжении, столь глубоко спрятана за орбиталями серы, что протон не в состоянии подойти на расстояние, необходимое для образования связи.
Вообще фуран, пиррол и тиофен относят к p-избыточным гетероциклам (классификация профессора А.Ф. Пожарского). Бензол является p-эквивалентной системой – на шесть атомов цикла приходится шесть p-электронов. В пятичленных гетероароматических соединениях шесть p-электронов делокализованы на пяти атомах кольца, на каждом атоме электронная плотность больше, чем в бензоле – p-избыточность.
p-Избыточность подсказывает, что пятичленные гетероароматические соединения вступают в реакции SEAr легче чем бензол. Это предположение подтверждено экспериментом – фуран, пиррол и тиофен по активности в реакциях электрофильного замещения сравнимы с наиболее активными производными бензола – анилином и фенолом. Вместе с тем нельзя забывать о ацидофобности фурана и пиррола.
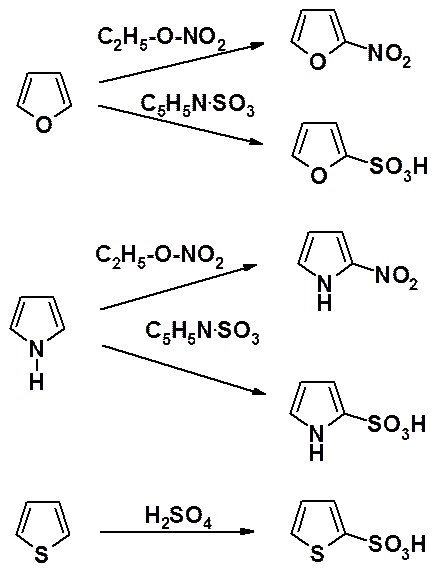
Фуран и пиррол нитруют алкилнитратами – алкиловыми эфирами азотной кислоты, а сульфируют с помощью пиридинсульфотриоксида – комплекса пиридина с оксидом серы (IV).
Высокую реакционную способность гетероциклов демонстрирует участие пиррола в реакциях Раймера-Тимана, приводящей к пирролкарбальдегиду, и азосочетания в качестве азосоставляющей.
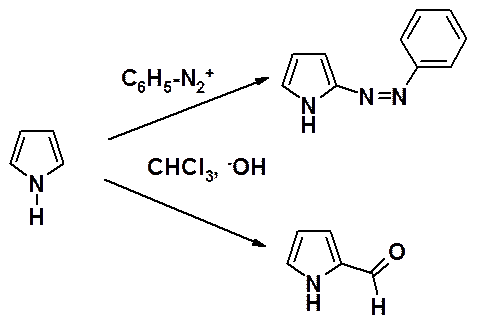
Кислые свойства пиррольного атома азота используются для получения солей, которые являются исходными соединениями для синтеза алкил- и ацилпирролов.
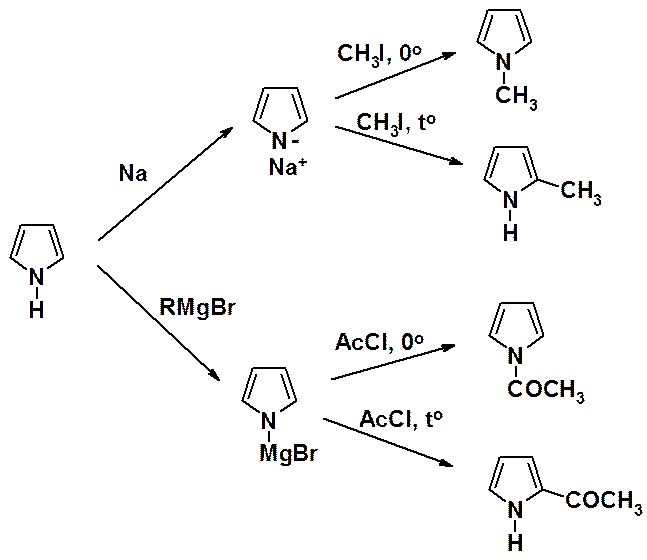
Пиррольная система чрезвычайно важна, поскольку входит в состав молекул, играющих важную роль в процессах жизнедеятельности.
Нагреванием пиррола с муравьиной кислотой Г. Фишер в 1935 г. получил темно-красные кристаллы вещества, названного порфином.
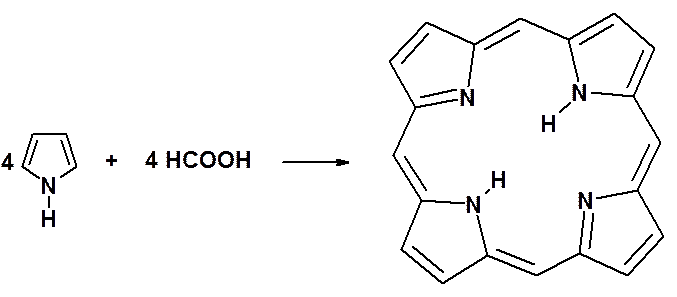
Четыре пиррольных атома азота способны образовывать комплексные соединения с двухвалентными металлами (железом, магнием, кобальтом).
Если в порфиновой системе есть какие-либо заместители, такие вещества называют порфиринами. К порфиринам относятся: хлорофилл, гем, витамин В12 и др. важные биологически активные соединения.
Красное красящее вещество крови (переносчик кислорода) – гемоглобин – вещество, в котором белок координационно связан с гемом (порфирином). Молекула гема:
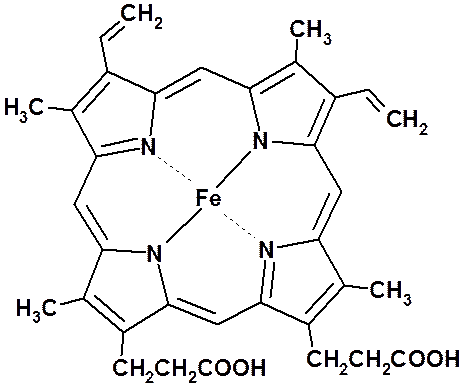
Молекула хлорофилла А:
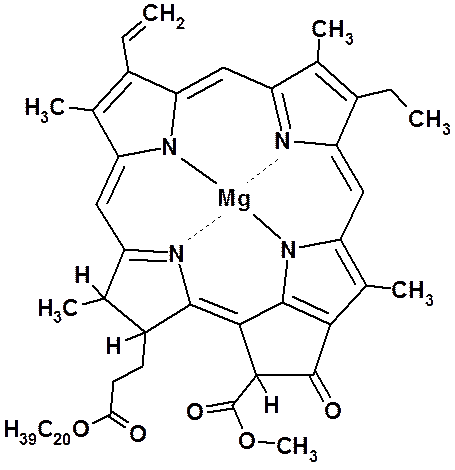
· Природные источники и синтетические методы получения. Строение, понятие о пиридиновом атоме азота. p-Дефицитность. Основность пиридина и проявление нуклеофильных свойств: реакции с электрофилами по атому азота (протонирование, алкилирование) и образование N-окисей. Влияние гетероатома на реакционную способность пиридинового цикла в целом и его отдельных положений. Реакции электрофильного замещения водорода в пиридине и его N-окиси. Реакции нуклеофильного замещения водорода, галогенов и других легко уходящих групп. Влияние кватернизации и N-оксидирования на реакционную способность.
· Влияние местоположения функциональной группы в цикле на свойства амино- и оксипиридинов. Таутомерия амино- и оксипиридинов.
· Строение, номенклатура. Синтез хинолина по методу Скраупа. Сходство и различия химических свойств хинолина и пиридина.
· Пиридазин, пиримидин, пиразин, урацил, тимин. Методы построения ядра. Зависимость химических свойств гетероциклов от количества и положения гетероатомов в кольце. Пурины и их значение как фрагментов нуклеиновых кислот.
Шестичленные гетероароматические соединения – гетероаналоги бензола. Среди систем с одним гетероатомом наиболее важны азины, содержащие азот. Циклы с кислородом (пиран) и серой (тиопиран) ароматических характер имеют только в виде катионов.
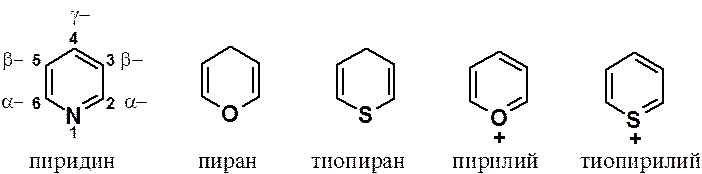
Пиридин содержится в каменноугольной смоле, из которой его добывают, также как и его ближайшие гомологи – метилпиридины (пиколины). Пиридиновые производные получают, как правило, функционализацией пиридина или его производных. В некоторых случаях пиридины получают замыканием гетерокольца, что обычно приводит к гидрированным производным.
Молекула пиридина представляет собой почти правильный шестиугольник - расстояния между атомами углерода 1,39 Å (как в бензоле). Две связи углерод-азот одинаковы, их длина 1,37 Å (длина одинарной C-N связи – 1,47 Å, длина двойной C=N связи 1,28 Å). Все атомы находятся в sp2-гибридизованном состоянии. Перекрывание орбиталей не участвующих в гибридизации приводит к торообразным 6p-электронным облакам над и под плоскостью молекулы.

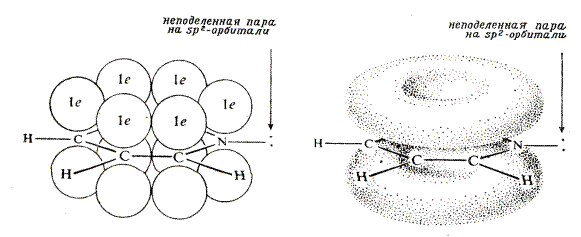
Рис. 44.1. Молекула пиридина
Атом азот в пиридине по своим свойствам заметно отличается от пиррольного. Орбиталь, несущая неподеленную пару электронов, расположена в плоскости пиридинового кольца, т.е. под углом 90о к орбиталям, участвующим в сопряжении. При такой геометрии орбиталей невозможно взаимодействие между электронами, участвующими в сопряжении и неподеленной парой электронов атома азота. Шестичленные гетероароматические соединения относят к p-дефицитным системам. Хотя формально на шесть атомов цикла приходится шесть p-электронов, акцепторный гетероатом сдвигает к себе электронную плотность, обедняя атомы углерода. Пиридин проявляет основные свойства. Он намного основнее пиррола. Основность пиридина несколько больше, чем у ароматических, но заметно меньше, чем у алифатических аминов. Избыток электронной плотности у гетероатома позволяет сделать вывод: пиридиновый атом азота – основный и нуклеофильный центр. Понятие «пиридиновый атома азота» применяется ко всем азотсодержащим гетероциклам, в которых атом азот обладает свойствами аналогичными атому азота пиридина.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.