· Щавелевая кислота: синтез, декарбоксилирование, декарбонилирование, окисление. Диэтилоксалат и реакции сложноэфирной конденсации.
· Малоновая кислота и ее производные: конденсация с карбонильными соединениями, декарбоксилирование и причины легкости его протекания. Свойства и синтетическое использование малонового эфира. Присоединение по активированной кратной связи (реакция Михаэля), конденсации с карбонильными соединениями (реакция Кневенагеля), образование натриймалонового эфира, алкилирование, получение карбоновых кислот.
· Янтарная и глутаровая кислоты: образование циклических ангидридов и имидов. Сукцинимид, его взаимодействие с бромом и щелочью, использование N-бромсукцинимида в органическом синтезе.
· Адипиновая кислота и ее производные: свойства и пути использования.
· Фталевые кислоты. Фталевый ангидрид, использование для синтеза трифенилметановых красителей, антрахинона. Фталимидный синтез, сложные эфиры и их практическое использование. Терефталевая кислота и использование ее производных.
Нитрилами называют органические соединения, в молекуле которых присутствует нитрильная (цианидная) группа.
![]()
Хотя в формуле нитрилов ничто не указывает на карбоновые кислоты, их рассматривают как производные именно этого класса органических веществ. Единственным основанием для такого отнесения, является тот факт, что гидролиз нитрилов приводит к карбоновым кислотам или их амидам (см. выше).
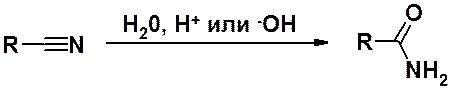
Нитрилы могут быть получены дегидратацией амидов, с использованием сильных водоотнимающих средств.
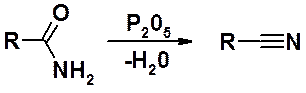
Нитрилы восстанавливаются труднее других производных карбоновых кислот. Их восстановление может быть проведено: каталитическим гидрированием, комплексными гидридами металлов или натрием в спирте. В любом случае образуется первичный амин.
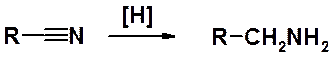
Первичные нитрилы в реакциях с многоатомными фенолами и их эфирами способны выступать в качестве ацилирующих агентов (реакция Хёша-Губена).
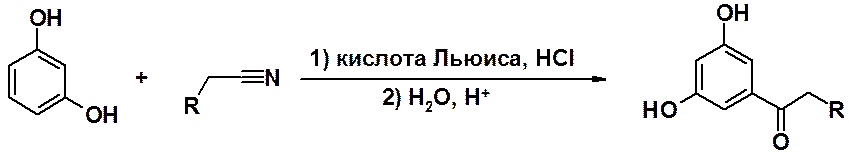 Эта реакция удобный путь получения
кетонов ароматического ряда.
Эта реакция удобный путь получения
кетонов ароматического ряда.
В присутствии красного фосфора бром вступает в реакцию замещения водорода в a-положении к карбокси-группе (реакция Хелля-Фольгарда-Зелинского).
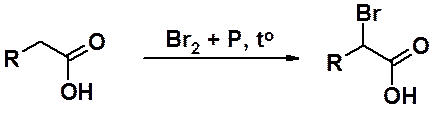
В отсутствие фосфора реакция идет очень медленно. Роль фосфора в образовании PBr3, который значительно активнее в реакции, чем бром. Трибромид фосфора взаимодействует с кислотой, образуя бромангидрид. Далее протекает реакция, аналогичная галогенированию карбонильных соединений в a-положение. На заключительной стадии реакции карбоновая кислота превращается в бромангидрид и продолжает реакцию, а последний превращается в a-бромкарбоновую кислоту.
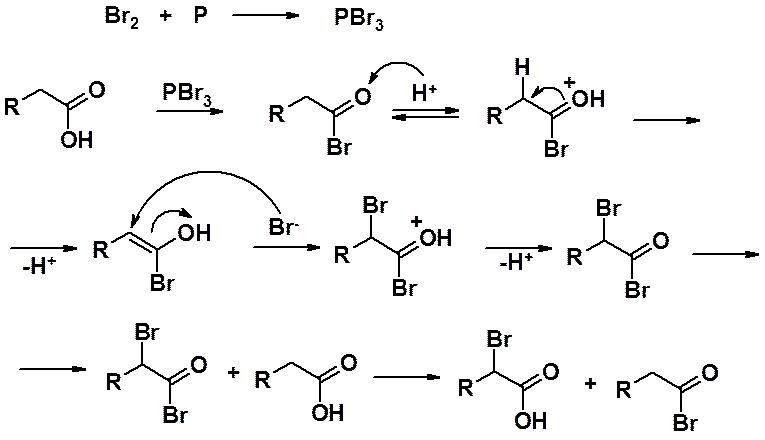
Реакция приводит исключительно к a-галогенопроизводным и ограничена только карбоновыми кислотами, имеющими в этом положении хотя бы один атом водорода. Производные хлора обычно не получают, из-за меньшей селективности процесса хлорирования. В этом случае реакция практически всегда осложнена процессом свободнорадикального замещения по всем атомам углеводородной цепи.
a-Бромкислоты используют как исходные продукты для получения различных замещенных карбоновых кислот. Легко проходят реакции нуклеофильного замещения галогена с образованием, например, гидрокси- или аминокислот, а также реакции дегидрогалогенирования с получением непредельных карбоновых кислот.
Дикарбоновые кислоты – соединения, в молекуле которых содержатся две карбоксильные группы. Расположение карбокси-групп может быть любым: от a- (у соседних углеродов до бесконечно далекого. В зависимости от строения углеводородного остатка они могут быть алифатическими, ароматическими и т.д. Некоторые дикарбоновые кислоты и их названия были приведены ранее.
Дикарбоновые кислоты могут быть получены гидролизом динитрилов, окислением первичных диолов и диальдегидов, окислением диалкилбензолов. Эти методы рассмотрены в предыдущих разделах.
Некоторые алифатические дикарбоновые кислоты удобно получать окислительным расщеплением циклоалкилкетонов. Например, окисление циклогексанола приводит к адипиновой кислоте.
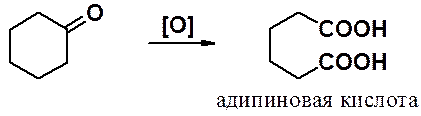
Методы синтеза дикарбоновых кислот с помощью малонового эфира будут рассмотрены ниже в этом разделе.
Кислотность дикарбоновых кислот выражена ярче, чем в монопроизводных. Следует учитывать, что карбокси-группы диссоциируют последовательно, а не одновременно.
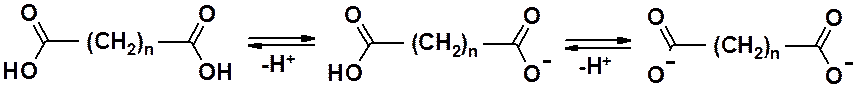
Константы первой и второй диссоциаций заметно отличаются. Вообще, кислотность в этом ряду зависит от положения карбоксильных групп. Поскольку они проявляют акцепторные свойства – близкое расположение увеличивает кислотность. У щавелевой кислоты первая рКа около 2. Вторая диссоциация затруднена, потому что карбоксилат-анион – донорный заместитель. У всех дикарбоновых кислот константа диссоциация второй карбокси-группы меньше, чем у уксусной кислоты. Единственное исключение – щавелевая кислота. Вторая константа диссоциации щавелевой кислоты близка аналогичному показателю уксусной. Следовательно, дикислоты могут, в зависимости от условий, образовывать кислые и двойные соли.
Большинство химических реакций, известных для монопроизводных, протекают и в ряду дикарбоновых кислот. Следует учитывать, что в зависимости от условий проведения реакций могут образовываться, например, кислые эфиры или диэфиры. Аналогичная ситуация с амидами дикарбоновых кислот.
Заметные различия наблюдаются в поведении дикарбоновых кислот при нагревании. Результат зависит от взаимного расположения карбокси-групп в углеродной цепи.
Если между карбоксильным группами находится 4 или больше СН2-групп, нагревание кальциевых или бариевых солей таких кислот без растворителя приводит к циклоалкилкетонам, у которых в цикле на один углерод меньше, чем в исходной кислоте.
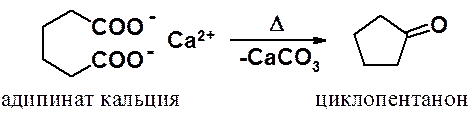
Янтарная и глутаровая кислоты (две и три СН2-группы, соответственно) при нагревании образуют циклические ангидриды. Аналогичная реакция происходит и с непредельной малеиновой кислотой.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.