Функциональная группа - структурный фрагмент молекулы, характерный для данного класса органических соединений и определяющий его химические свойства.
Функциональная группа – это гетероатом или группа атомов, содержащая гетероатом; или кратную связь; часто – и то и другое (см. альдегиды, кетоны, кислоты).
Виды некоторых классов органических соединений и названия их функциональных групп для [М.н.].
|
Класс соединения |
Функциональная группа |
|
|
Вид |
Название |
|
|
Галогениды Нитросоединения Амины Фенолы |
-F, -Cl, -Br, -I -NO2 -NH2 ( ) OH |
(в приставке) фтор-, -хлор, бром-, иод- нитро- амино- окси- |
|
Алкены Алкины |
>С═С< - С≡С - |
(в суффиксе) -ен- -ин- |
|
Арены Спирты Альдегиды Кетоны Карбоновые кислоты |
( R ) - OH -C (R) - C – (R) O -C |
(в окончании) -бензол -ол -аль -он -овая кислота |
Оксисоединения – производные углеводородов, в молекулах которых один или несколько атомов водорода заменены на оксигруппу (-ОН).
Подразделяют оксисоединения:
- по количеству ОН групп в молекуле (по атомности): одно-, двух-, трех-, многоатомные.
- По виду радикала, с которым связана ОН группа: предельные, непредельные, циклические, алифатические, ароматические.
- По положению ОН в углеродном скелете:
а) Первичные, вторичные и третичные алифатические спирты (по виду углерода –С(I), С(II), С(III) – с которыми связана ОН группа);
б) Фенолы
в) Ароматические спирты (бензольное кольцо и ОН группа разделены одной или несколькими группами –СН2 –).
Алканолы – одноатомные насыщенные алифатические спирты R-OH с общей формулой гомологического ряда CnH2n+1OH. Первый (простейший) представитель СН3-ОН – карбинол. производные карбинола, в молекуле которого один или несколько ат Для (Р.н.) алканолы представляются как омов водорода замещены радикалами.
Для [М.н.] спиртов наличие оксигруппы указывается окончанием “ол“, добавляемым к полному названию базового (длинной углеродной цепи) углеводорода, ее “адрес“ – номер углерода с которым связана ОН группа; углеродная цепь нумеруется со стороны функциональной группы.
Применяются так же названия спиртов по названиям радикалов, с которыми связана ОН группа:
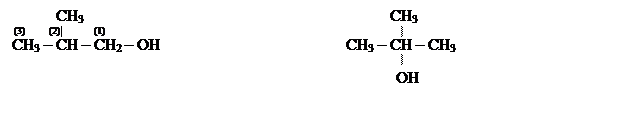 |
[2-метилпропанол-1] [2-метил пропанол-2]
(изопропилкарбинол) (триметилкарбинол)
Изобутиловый спирт Трет- бутиловый спирт
(первичный спирт) (третичный спирт)
Источников изомерии у спиртов два: а) углеродный скелет; б) положение ОН группы.
Спирты С1 – С11 жидкости, с С12 твердые вещества, легче воды (ρ<1г/мл).
Низшие спирты (С1 – С3) - хорошо растворимые в воде жидкости, с резким спиртовым запахом. Их жидкое состояние связано с высокой полярностью оксигруппы и наличием водородных связей, которыми молекулы спирта ассоциированы между собой:
∙∙∙О–Н∙∙∙О–Н∙∙∙О–Н∙∙∙О–Н∙∙∙О–Н∙∙∙О–Н∙∙∙О–Н∙∙∙О–Н∙∙∙
│ │ │ │ │ │ │ │
R R R R R R R R
(Валентный угол R-O-H в молекуле спирта – около 109◦).
Спирты (С4 – С6)- имеют резкий, неприятный “сивушный” запах и ограниченно растворимы в воде. Растворимость в воде спиртов ухудшается с увеличением радикала.
Многие спирты ядовиты. Так 10-15 мл метанола вызывают у человека слепоту, а большее количество смерть.
1) Образование алкоголятов в реакциях с активными металлами ( K, Na,Ca ):
2)
C2H5OH + Na → C2H5ONa↓ + 1/2H2↑
(этанол) (этанолят натрия)
Получающиеся при этом алкоголяты (вещества солеобразного типа) легко гидролизуются водой.
C2H5ONa + Н2О → C2H5OH + NaОН
Алкоголяты используются в реакциях с галогенидами, например:
![]() R – O – Na + Br –R` → R – O – R` + NaBr
(алкоголят) (галогенид) (простой эфир)
R – O – Na + Br –R` → R – O – R` + NaBr
(алкоголят) (галогенид) (простой эфир)
Следует подчеркнуть, что “кислотные“ свойства (отщепление протона) у спиртов проявляются очень слабо: спирты не реагируют со щелочами, а водные растворы спиртов имеют нейтральную реакцию на лакмус.
3) Дегидратация спиртов осуществляется действием на них при нагревании водоотнимающих агентов (H2SO4 конц., P2O5 и др.)
а) Межмолекулярная (“мягкая“) дегидратация:
H2SO4 конц.
![]() C2H5
– OH + НO – C2H5 ¾¾¾¾→ C2H5
– О – C2H5 + Н2О (этиловый
спирт) ок.140◦С (диэтиловый эфир)
C2H5
– OH + НO – C2H5 ¾¾¾¾→ C2H5
– О – C2H5 + Н2О (этиловый
спирт) ок.140◦С (диэтиловый эфир)
Объемное соотношение спирт: кислота = 2:1
б) Внутримолекулярная (“жесткая“) дегидратация:
H2SO4 конц.
СН2 – СН2 ¾¾¾¾→ СН2 ═ СН2↑ + Н2О [62]
![]() │ │ ок. 170 ◦С (этилен)
│ │ ок. 170 ◦С (этилен)
H OH
(этиловый спирт)
Объемное соотношение спирт: кислота = 1:1
При дегидратации спирта в лабораторных условиях получается смесь обоих продуктов. В случае действия H2SO4 на смесь спиртов (например метиловый + этиловый) получается смесь трех эфиров (диметиловый, диэтиловый и метилэтиловый), а доля выхода каждого из них не более 1/3. Для получения несимметричного эфира удобно использовать реакцию с NaOR и BrR1 (здесь теоретический выход эфира равен единице).
4)
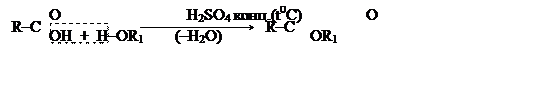 Реакции этерификации (спирты с кислотами)
относятся к числу важнейших свойств спиртов и карбоновых кислот, а продукты их взаимодействия
– сложные эфиры – широко распространенные в природе соединения
(цветочно–фруктовые эфиры, воски, жиры).
Реакции этерификации (спирты с кислотами)
относятся к числу важнейших свойств спиртов и карбоновых кислот, а продукты их взаимодействия
– сложные эфиры – широко распространенные в природе соединения
(цветочно–фруктовые эфиры, воски, жиры).
[63]
(Кислота) (Спирт) (Сложный эфир)
5) Замещение спиртовой группы на галоген.
![]() t0C
t0C
а) R – OH + Н – Br R – Br + Н2О
Более надежным приемом является действие на спирты PCl5:
![]() б)
R – OH + PCl5 R – Cl + POCl3
+ НCl
б)
R – OH + PCl5 R – Cl + POCl3
+ НCl
6) Реакции окисления спиртов идут по-разному, в зависимости от вида спирта:
 О – H
О – H
![]() │ O
│ O
а) CH3 –C – H + Cu O СH3 – C + Cu
│ (–H2O) H
H
(Первичный спирт) (Альдегид)
 б) H
б) H
![]() │ t0C
O
│ t0C
O
![]() CH3 – C – OH + CuO СH3
– C + Cu
CH3 – C – OH + CuO СH3
– C + Cu
│ (–H2O) CH3
CH3
(Вторичный спирт) (Кетон)
в) Третичные спирты окисляются трудно и с разрушением углеродного скелета молекулы.
г) Все спирты хорошо горят:
CnH2n+1OH + nO2 → nCO2 + (n-1)H2O
В свободном виде спирты в природе встречаются в небольших количествах.
Получают спирты:
а) Щелочным гидролизом алкилгалогенидов (замещением галогена на гидроксил); сравним с действием на алкилгалогениды спиртового раствора щелочи:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.