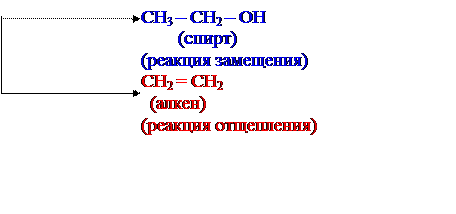
 NaOH (водн.)
NaOH (водн.)
(- NaBr)
CH3 – CH2 – Br
(галогенид)
NaOH (спирт.)
(- НBr)
б) Гидратацией алкенов (присоединением воды в присутствии минеральных кислот).
![]() (t0C)
(t0C)
![]() CH3 – CH = CH2 +
H–OH → CH3 – CH – CH3
CH3 – CH = CH2 +
H–OH → CH3 – CH – CH3
(H+) │
(Пропен) OH
(Пропанол 2)
в) Гидрированием (восстановлением) альдегидов и кетонов
Получение спиртов в промышленности – многотоннажные производства.
Метанол (около 20 млн. т/год) получают при гидролизе древесины и из синтез – газа:
t0C; давл;
СО + 2Н2 ¾¾¾¾→ CH3 – OH
Katal
Идет на производство формальдегида, оргстекла; используется как растворитель и как топливо для ДВС.
Этанол (около 3 млн. т/год) технический получают гидратацией этилена водяным паром, а медицинский - брожением углеводов. Используется для получения ацетальдегида и уксусной кислоты, дивинила (и далее каучука, и резины), как растворитель лекарств и в ликеро–водочной промышленности.
Вторбутанол (около 850 тысяч т/год) – основной компонент тормозных жидкостей автомобилей.
Многоатомные спирты содержат в одной молекуле несколько гидроксилов у разных атомов углерода:
H2C – CH2 H2C – CH – CH2
│ │ │ │ │
OH OH OH OH OH
Этиленгликоль Глицерин
[этандиол – 1,2] [пропантриол –1,2,3]
Это вязкие сиропообразные жидкости, без цвета и запаха, хорошо растворимые в воде, имеющие плотности, соответственно –1,11 и 1,26 г/мл.
По химическим свойствам схожи с обычными (одноатомными) спиртами: реагируют со щелочными металлами, внутри- и межмолекулярно дегидратируются, образуют сложные эфиры с кислотами.
Отличие полиолов в том, что они могут образовывать моно-, ди- и тризамещенные продукты (по количеству прореагировавших гидроксилов).
Качественной для многоатомных спиртов, является их реакция со свежеосажденным гидроксидом меди (II): светло- голубой осадок Cu(OH)2 растворяется в многоатомном спирте, с образованием раствора ярко синего цвета:
 CH2 –O H + HO CH2
–O
CH2 –O H + HO CH2
–O
│ Cu ¾¾→ ½ Cu
CH2 –O H HO (-2H2O) CH2 –O
Этиленгликоль Гликолят меди (II)
 Очень важными являются реакции образования сложных эфиров глицерина с
карбоновыми кислотами и с HNO3:
Очень важными являются реакции образования сложных эфиров глицерина с
карбоновыми кислотами и с HNO3:
CH2 –O – NO2 CH2 –OH CH2 –O –C –R
│ 3HО–NO2 │ 3HO–C–R │
CH –O – NO2 ←¾ CH –OH ¾→ CH –O –C –R │ (-3H 2O) │ (-3H2O) │
CH2 –O – NO2 CH2 –OH CH2 –O –C –R
[Нитроглицерин] [Глицерин] [Жир*[1]]
Нитроглицерин – взрывчатое вещество (входит в состав динамита), при ударе, трении, от электрической искры взрывается с выделение большого количества газов:
C3H5(ONO2)3 → 12CO2 + 6N2 + 10H2O + O2
Глицерин и этиленгликоль очень широко используются, в различных областях: в медицине и парфюмерии (кремы и мази), в консервной промышленности, при изготовлении синтетических волокон (лавсан) и пластмасс (целлофан, полиуретаны, глифталевые смолы и др.); входят в состав антифризов.
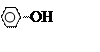 Термин “фенол” используется в двух значениях:
Термин “фенол” используется в двух значениях:
а) Названия соединения (оксибензол);
б) класс органических соединений, в которых гидроксил связан непосредственно с бензольным кольцом.
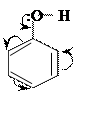 Фенол – кристаллы розоватого цвета,
малорастворим в воде, хорошо в щелочах. Молекула фенола - яркий пример
взаимного влияния атомов в молекуле. Из-за взаимодействия не поделенных электронных
пар атома кислорода с π-электронами бензольного кольца связи (С –О) и (О –Н) имеют
различную прочность (а не примерно одинаковую, как в молекуле спиртов). Связь О
–Н значительно менее прочна, чем и определяются кислотные свойства фенолов:
водный раствор фенола имеет кислую среду и называется карболовой кислотой.
Фенол – кристаллы розоватого цвета,
малорастворим в воде, хорошо в щелочах. Молекула фенола - яркий пример
взаимного влияния атомов в молекуле. Из-за взаимодействия не поделенных электронных
пар атома кислорода с π-электронами бензольного кольца связи (С –О) и (О –Н) имеют
различную прочность (а не примерно одинаковую, как в молекуле спиртов). Связь О
–Н значительно менее прочна, чем и определяются кислотные свойства фенолов:
водный раствор фенола имеет кислую среду и называется карболовой кислотой.
C6H5OH ↔ C6H5O - + H+ Фенол Фенолят-ион
Фенол, в отличие от спиртов, легко реагирует со щелочами и некоторыми солями.
C6H5OH + NaOH → C6H5ONa + H2O
Фенолят натрия
3C6H5OH + FeCl3 → Fe(C6H5O)3 + 3HCl
Последняя реакция (с FeCl3) является качественной на фенолы: образуется фиолетовый раствор железо-фенольного комплекса.
Гидроксил, в свою очередь, оказывает влияние на свойства бензольного кольца. Фенол, в отличие от бензола, реагирует с бромом в обычных условиях и очень легко нитруется:
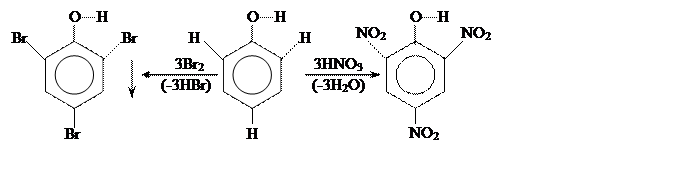
[2,4,6 –трибромфенол] [2,4,6 –тринитрофенол]
(пикриновая кислота)
Присутствие нитрогрупп делает еще более подвижным водород фенольного гидрооксила: пикриновая кислота по силе приближается к серной, легко образует соли – пикраты. Это – бризантные ВВ, используются для снаряжения капсюлей патронов и снарядов.
Повышенная подвижность атомов водорода бензольного кольца фенола в позициях 2, 4 и 6 (орто- и пара-) используется в реакциях поликонденсации фенола с формальдегидом:
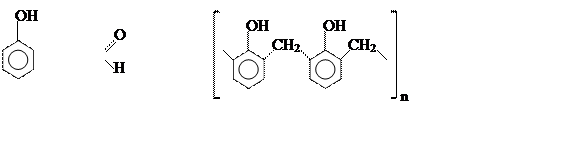 |
![]() 2n +2n H–C →
2n +2n H–C →
(–2nH2O)
Образующиеся в результате фенол- формальдегидные смолы (резолы, бакелиты) широко используются для изготовления из фенопластов самых различных материалов и изделий (стеклопласты, текстолиты, пенопласты, диэлектрики и др.)
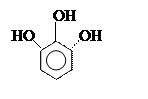
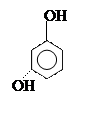

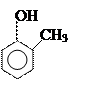
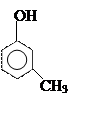 Фенолы
могут быть как одноатомные (например крезолы), так и полиоксисоединения:
Фенолы
могут быть как одноатомные (например крезолы), так и полиоксисоединения:
орто- пара- метакрезолы резорцин пирогаллол
[2-метил [4-метил [3-метил [1,2-диокси [1,2,3-триокси
фенол] фенол] фенол] бензол] бензол]
Получается фенол из каменноугольной смолы, путем коксования и синтетически:
(а) кумольный способ (1949 г):
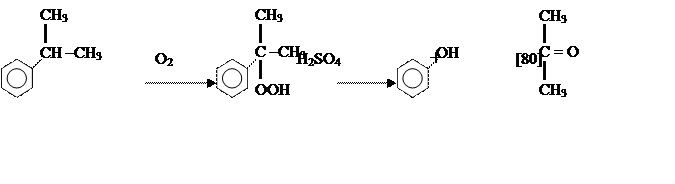 |
кумол гидроперекись кумола фенол ацетон
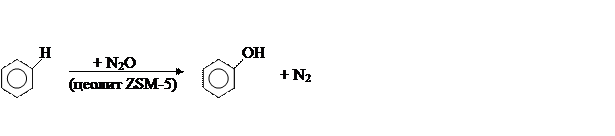 |
(б) метод института катализа СОРАН (1995г):
Метод был обнаружен при решении экологической задачи утилизации N2O, являющегося отходом в производстве капролактама. Наилучшим раскислителем N2O оказался бензол, превращающийся при этом в фенол почти со 100% -ным выходом.
Производные углеводородов, в молекулах которых у одного атома углерода два атома водорода замещены на атом кислорода, называются карбонильными. Группа атомов (С=О) называется оксогруппа, а молекулы, ее содержащие –оксосоединениями. Их общая формула CnH2nO.
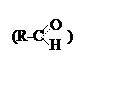 Если карбонильный кислород находится у первичного
углерода –это альдегиды .
Если карбонильный кислород находится у первичного
углерода –это альдегиды .
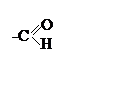 |
Их функциональной группой является группа атомов
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.