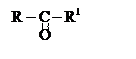 Если карбонильный кислород находится у вторичного
углерода –это кетоны .
Если карбонильный кислород находится у вторичного
углерода –это кетоны .
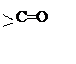 |
Их
функциональной группой является оксогруппа ( ),
связанная с двумя углеводородными радикалами (кетогруппа).
Источников изомерии здесь два: (а) – изомерия С–скелета и (б) различное положения карбонильного кислорода в С–цепи.
Для [М.н.] углеродная цепь номеруется со стороны функциональной группы, название которой добавляется к полному названию С–цепи: "–аль" – для альдегидов ("адрес" не указывается, всегда №1), и "–он" –для кетонов (с добавлением "адреса" карбонильного кислорода). Для наименования кетонов широко используется [Р.н.]: называются радикалы, связанные с кетогруппой и добавляется слово кетон – см. ниже.
Низшие оксосоединения имеют тривиальные названия:
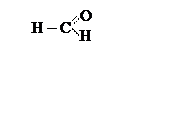
формальдегид,
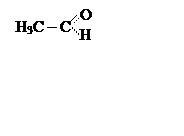
ацетатадегид,
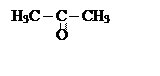
ацетон ,
кроме того, используются названия альдегидов по названию кислот, которые образуются при окислении этих альдегидов.
 |
![]() СН3 –
СН2 – СН2 – C СН3 – СН2 –
С –
СН2 – СН3
СН3 –
СН2 – СН2 – C СН3 – СН2 –
С –
СН2 – СН3
О
[Бутаналь] [пентанон - 3]
масляный альдегид диэтилкетон
 |
![]() СН3 – СН – C СН3 – СН2 – СН2 – С –СН3
СН3 – СН – C СН3 – СН2 – СН2 – С –СН3
|
[2 - метил пропаналь] [пентанон -2]
изомасляный альдегид метилпропилкетон
![]()
![]() СН3 – СН2 – С –СН3 СН3 – СН – С –СН3
СН3 – СН2 – С –СН3 СН3 – СН – С –СН3
О СН3 О
[бутанон -2] [3метилбутанон -2]
метилэтилкетон метилизопропилкетон
Муравьиный альдегид (метаналь, формальдегид) – газ (tкип= -190С), уксусный альдегид (этаналь, ацетальдегид) –"почти" газ (tкип= +20,80С). Остальные низшие оксосоединения до (С11) –жидкости; высшие –твердые вещества.
Первые (до С3 включительно) растворимы в воде, далее – только в органических растворителях. Плотность всех алифатических оксосоединий меньше 1 г/мл (легче воды), ароматических –больше 1 г/мл:
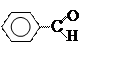 |
|||
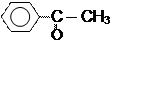 |
|||
Бензальдегид Метилфенилкетон
(ρ = 1,045 г/мл) (ρ = 1,028 г/мл)
Аальдегиды и кетоны относятся к числу реакционно-способных органических соединений. При этом альдегиды наиболее активны.
Активность оксосоединений обусловлена электронным строением оксогруппы: двойная связь С=О сильно поляризована, т.к. π – электроны смещены в сторону электроотрицательного атома кислорода от карбонильного углерода. Этим определяется направление (порядок) присоединения полярных молекул:
 X
X
![]() │
│
R ─ C(+δ) ═ O(–δ) + H + ─ X - → R ─ C ─ OH │ │
R(H) R(H)
Так, одним из свойств альдегидов и кетонов является способность присоединять спирты с образованием полуацеталей, соединений, определяющих запахи некоторых пищевых продуктов (например, хлеба).
 О HO
О HO
║ │
![]() CH3
─ C – H + HO ─ C2H5 → CH3 ─ CH ─ O ─ C2H5
CH3
─ C – H + HO ─ C2H5 → CH3 ─ CH ─ O ─ C2H5
[этаналь] [этанол] [1 – этоксиэтанол –1]
полуацеталь
Восстановление карбонильных соединений (гидрирование), приводит к образованию спиртов:
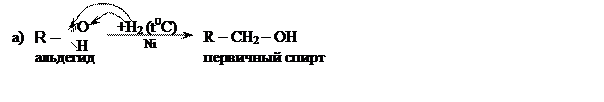 |
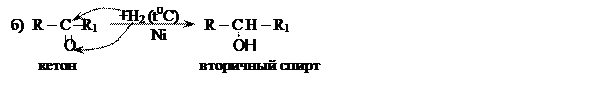 |
Реакции гидрирования идут при нагревании, в присутствии никелевого катализатора.
Реакции окисления альдегидов и кетонов протекают в различных условиях.
Альдегиды окисляются очень легко, даже такими слабыми окислителями как аммиачный раствор оксида серебра (а) и гидроксид меди –II (б):
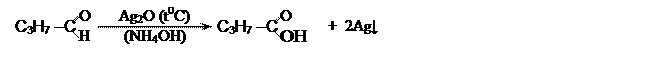 |
[бутаналь] [бутановая кислота]
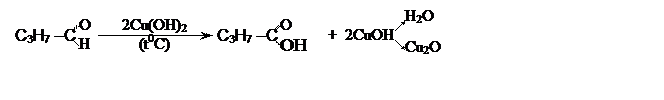 Серебро выделяется на стенках стеклянного сосуда в виде блестящего
металлического налета - реакция "серебряного зеркала" является
качественной на альдегидную группу.
Серебро выделяется на стенках стеклянного сосуда в виде блестящего
металлического налета - реакция "серебряного зеркала" является
качественной на альдегидную группу.
[пропаналь] [пропановая кислота]
Реакция "медного зеркала" – появление оранжевого или красного окрашивания – также является качественной на альдегидную группу.
Кетоны окисляются трудно и только сильными окислителями. При этом углеродный скелет молекулы разрушается около оксогруппы, с образованием из "осколков" "маленьких" карбоновых кислот:
[O]
СН3 – СН2 – С – СН2 – СН3 → СН3 – СН2 – СOOН + СН3 – СOOН
║
O
[пентанон-3] [пропановая кислота] [этановая кислота]
Общих способов получения три:
1) Окисление соответствующих спиртов (см. р. 66 и 67)
2) Гидратацией по М.Г. Кучерову ацетилена (получается ацетальдегид-р. 34) и гомологов ацетилена (получаются кетоны – р. 35)
3) Щелочным гидролизом геминальных дигалогенидов из-за неустойчивости получающихся при этом геминальных диолов (правило А.П. Эльтекова):
 Br OH
O
Br OH
O
│ +2NaOH │ ║
а) R – C – Br → R – C – OH → R – C │ (-2NaBr) │ -(H2O) │
H H H
 Cl OH
O
Cl OH
O
│ +2NaOH │ ║
б) R –C – Cl → R – C – OH → R – C │ (-2NaCl) │ -(H2O) │
R1 R1 R1
4) много ацетона получается при синтезе фенола кумольным способом.
Карбонильные соединения широко используются и сами, и как промежуточные соединения для получения других технически ценных продуктов.
–Формальдегид применяется как консервант биопрепаратов и для дубления кож в виде формалина (40 % водного раствора); именно формальдегид, входящий в состав дыма, "отвечает" за эффект копчения мясных и рыбных продуктов; широко используется для получения фенол - формальдегидных смол (р. 79) и полиформальдегида.
–Ацетальдегид – для получения этанола и уксусной кислоты.
– Ацетон – как растворитель пластмасс и в производстве ацетатного щелка; для получения метакриловой кислоты и далее, оргстекла и др.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.