3.6 Константа равновесия обратимой химической реакции
Скорость
простой обратимой реакции задается соотношением (3.11). Условием равновесия
такой реакции является r = 0, откуда (если положить ![]() и учесть, что
и учесть, что ![]() ,
, ![]() )
)
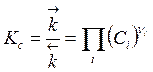 , (3.12)
, (3.12)
(i = 1, .. S - и исходные вещества и продукты)
Величина KС - определяется только температурой, свойствами реагирующих веществ и тепловым эффектом реакции и называется константой равновесия. Константы равновесия реакций рассчитываются по законам химической термодинамики, их можно найти в справочниках или определить экспериментально с использованием соотношения (3.12) по измеренным значениям концентраций Ci в условиях химического равновесия.
В частности, для идеальных газов из термодинамики следует, что изменение энергии Гиббса, в результате протекания реакции, и константа равновесия связаны соотношением
![]() , (3.13)
, (3.13)
где  (Дж на νi молей Ai),
(Дж на νi молей Ai),
![]() - энергия Гиббса образования вещества Ai при температуре T.
- энергия Гиббса образования вещества Ai при температуре T.
Если
вместо концентраций используются парциальные давления компонентов, то можно
ввести константу равновесия ![]() . При этом для
идеального газа имеет место соотношение
. При этом для
идеального газа имеет место соотношение 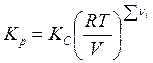 .
.
В
химической термодинамике при рассмотрении неидеальных газов или растворов вместо
концентраций вводят понятия летучести fi и активности ai, соответственно. При этом константа равновесия
представляется как функция летучестей или активностей, соответствующих
химическому равновесию, например, ![]() .
.
Если
необходимые величины известны при стандартной температуре T0
(обычно 298 К), то для вычисления ![]() можно пользоваться следующим
соотношением:
можно пользоваться следующим
соотношением:
![]()
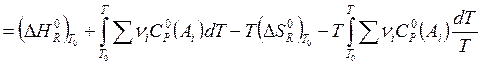 . (3.14)
. (3.14)
В упрощенном виде
![]() . (3.15)
. (3.15)
Температурную зависимость константы равновесия для случая P = const (в этом случае dH = dQ = TdS, dH/dT = TdS/dT) можно получить, дифференцируя (3.13) по d(1/T) с учетом (3.14), в виде уравнения Вант Гоффа:
![]() . (3.16)
. (3.16)
3.7 Температурная
зависимость константы скорости реакции (k). Связь энергии активации (E) и теплоты реакции (![]() )
)
Константа скорости реакции не зависит от концентрации и является только функцией температуры. Температурная зависимость дается эмпирическим законом Аррениуса (1889)
![]() (3.17)
(3.17)
или после логарифмирования
![]() , (3.18)
, (3.18)
откуда
![]() , (3.19)
, (3.19)
где E - энергия активации реакции ([E] = Дж/моль); k0 - предэкспоненциальный множитель (размерность [k0] = [К]), R = 8,31 Дж/(моль К) - газовая постоянная.
Соответственно для обратимой реакции
![]() ;
; ![]() . (3.20)
. (3.20)
Следовательно, для константы равновесия реакции можно получить

или
 . (3.21)
. (3.21)
Из (3.16), (3.21) легко получить, что тепловой эффект реакции

![]() . (3.22)
. (3.22)
Физический смысл энергии активации заключается в том, что эта величина, как это видно из рисунка 3.2, представляет собой минимальную энергию, которой должны обладать молекулы, чтобы преодолеть потенциальный барьер, обусловленный отталкиванием молекул, при их сближении на расстояние, достаточное для их химического взаимодействия.
Аррениусовские координаты
Уравнение
Аррениуса в форме (3.18) очень удобно для экспериментального определения
энергии активации (рисунок 3.3). Из (3.18) следует, что если экспериментально
определенную зависимость константы скорости от температуры построить в
координатах ![]() и 1/T (Аррениусовские координаты),
то она будет линейной. Прямая, соответствующая этой зависимости, отсечет на оси
ординат отрезок
и 1/T (Аррениусовские координаты),
то она будет линейной. Прямая, соответствующая этой зависимости, отсечет на оси
ординат отрезок ![]() , а тангенс угла ее наклона будет
равен
, а тангенс угла ее наклона будет
равен ![]() .
.
 |
 , (3.23)
, (3.23)
которое можно получить, умножив и разделив (3.17) на k(Tmf). В (3.23) Tmf - некоторая опорная температура, например, температура охлаждающей жидкости в реакторе и т.д.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.