- макрокинетика (описание «видимой» химической кинетики с учетом процессов тепло- и массопереноса).
Конверсия, селективность, выход, состав химических продуктов на выходе из реактора во многом зависят от соотношения скоростей протекающих в реакторе химических реакций. По этой причине скорость химической реакции является одним из важнейших параметров в теории химических реакторов.
Простые и сложные реакции
Химическая
реакция, описываемая уравнением (2.2), называется простой, если она протекает в
одну стадию, т.е. при одновременном взаимодействии ![]() молекул,
фигурирующих в уравнении. Например,
молекул,
фигурирующих в уравнении. Например,
H + Cl2 = HCl + Cl
В большинстве случаев исходные молекулы, прежде чем они соединятся в конечный продукт, претерпевают более сложную цепочку превращений, чем это следует из «обычного» стехиометрического уравнения. Маршрут реакции (последовательность простых стадий) называется механизмом реакции. Например, реакция хлорирования водорода H2 + Cl2 = 2HCl в действительности протекает на катализаторе (K) в несколько стадий
Cl2 + K ® 2Cl + K,
Cl + H2 ® HCl + H,
H + Cl2 ® HCl + Cl.
Реакции, протекающие в несколько стадий, называют сложными. При этом различают
- параллельные реакции;
- последовательные реакции;
- последовательно-параллельные.
Реакции могут быть гомогенными (протекают в одной фазе газ, жидкость), гетерогенными (хотя бы одна из стадий протекает на поверхности раздела фаз) и топохимическими, связанными с изменением структуры реагирующих твердых тел.
3.4 Понятия скорости химической реакции (rj) и скорости изменения содержания компонента (Ri)
Скорость химической реакции характеризует скорость изменения содержания реагирующих веществ и продуктов реакции в единице объема V реакционной смеси в результате реакции j.
Если мы имеем единственную простую реакцию
![]() ,
, ![]() , то, очевидно, что
скорости изменения содержания компонентов
, то, очевидно, что
скорости изменения содержания компонентов ![]() в
любой момент времени t будут находиться в соотношении
в
любой момент времени t будут находиться в соотношении
 , (3.6)
, (3.6)
т.е. вещество, для
которого ![]() больше, будет расходоваться (или
образовываться) с большей скоростью.
больше, будет расходоваться (или
образовываться) с большей скоростью.
Из
(3.6), (2.4) следует, что для любого i и времени t отношение  . Учитывая это, при наличии единственной
простой химической реакции ее скорость определяют обычно на основе соотношения
. Учитывая это, при наличии единственной
простой химической реакции ее скорость определяют обычно на основе соотношения
 . (3.7)
. (3.7)
Если
определить концентрацию i-го вещества как ![]() , то из
(3.7)
, то из
(3.7)

(или в случае V = const:  ) (3.8)
) (3.8)
Если одновременно протекает R реакций, которые можно охарактеризовать скоростями rj (j = 1,...R), то скорость изменения содержания реагента Ai в реакционной среде
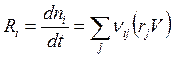 (3.9)
(3.9)
(или 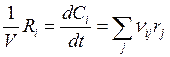 , если V = const),
, если V = const),
где 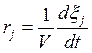 .
.
В
случае единственной простой реакции величина скорости реакции, определяемая
соотношением (3.7), не зависит от того, по изменению содержания какого
компонента она определялась (хотя и зависит от масштаба набора стехиометрических
коэффициентов ![]() ).
).
В случае сложных реакций или нескольких независимых, протекающих с участием одних и тех же веществ, скорость суммарной реакции, определяемая как скорость изменения содержания вещества в единице объема, будет зависеть от того, по какому веществу эта скорость определяется. Это видно из соотношений (3.9), если считать, что rj - это скорости простых реакций (или отдельных стадий). Наглядно это видно также из следующего примера сложной реакции.
 Пусть реакция A1
® A3 протекает через
промежуточное вещество A2 по схеме A1 ® A2, A2
® A3
(последовательные реакции, объем не изменяется). Зависимости концентраций C1
, C2 , C3 веществ A1, A2,
A3 от времени показана на рисунке 3.1. Для данного процесса
Пусть реакция A1
® A3 протекает через
промежуточное вещество A2 по схеме A1 ® A2, A2
® A3
(последовательные реакции, объем не изменяется). Зависимости концентраций C1
, C2 , C3 веществ A1, A2,
A3 от времени показана на рисунке 3.1. Для данного процесса
![]() .
.
Следовательно, R1 + R2 + R3 = 0 (где R1 = VdC1/dt, R2 = VdC2/dt, R3 = VdC3/dt), т.е. все скорости Ri будут взаимосвязаны, но ни одна из них не может рассматриваться как характерная для процесса в целом.
При рассмотрении сложных (многостадийных) реакций необходимо стремиться разбить реакцию на простые стадии (пусть будет R стадий). Тогда одно суммарное уравнение заменится на R простых реакций, скорость которых можно характеризовать величинами rj
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.