3 Элементы химической термодинамики и кинетики. 18
3.1 Баланс энергии при химическом превращении. 18
3.2 Изменение энтальпии в результате химической реакции. 19
3.3 Химическая кинетика. 21
3.4 Понятия скорости химической реакции (rj) и скорости изменения содержания компонента (Ri) 22
3.5 Закон действующих масс (зависимость скорости простой реакции от концентраций реагентов) 25
3.6 Константа равновесия обратимой химической реакции. 27
3.7 Температурная зависимость
константы скорости реакции (k). Связь энергии активации (E) и
теплоты реакции (![]() ) 28
) 28
3.8 Кинетика сложных реакций. 30
3.9 Гетерогенный катализ. Теория Лэнгмюра-Хиншельвуда. 32
3 Элементы химической термодинамики и кинетики
3.1 Баланс энергии при химическом превращении
В соответствии с первым законом термодинамики
![]() . (3.1)
. (3.1)
Здесь δQ - количество сообщенной системе теплоты; dU - изменение внутренней энергии; δW- суммарная работа, совершенная системой; PdV - работа, связанная с расширением системы; δW' - другие виды работы (электрическая, магнитная и т.д.).
Как правило, при протекании химических реакций работа связана только с расширением системы. В этом случае
![]() (3.2)
(3.2)
Если обозначить состояние системы до начала реакции индексом «1», после реакции - индексом «2», знаком ∆ - изменение величины в результате перехода из состояния 1 в состояние 2, то тепловой эффект реакции ∆Q можно определить путем интегрирования (3.2) в виде
![]() . (3.3)
. (3.3)
На практике при рассмотрении изменения энергии реагирующей системы рассматривают два основных случая:
1) температура системы меняется в результате реакции при постоянном объеме. В этом случае dV = 0 и из (3.3)
![]()
(тепловой эффект реакции равен изменению внутренней энергии);
2) температура системы меняется в результате реакции при постоянном давлении. В этом случае PdV = d(PV) и из (3.3)
![]()
(тепловой эффект реакции равен изменению энтальпии H = U + PV).
Далее будет рассматриваться в основном второй случай как наиболее часто встречающийся.
3.2 Изменение энтальпии в результате химической реакции
В случае реакции, характеризующейся стехиометрическим уравнением
![]() , изменение энтальпии
(теплоту реакции при постоянном давлении) при полной конверсии реагентов
(νi < 0) в продукты (νi > 0) при заданной температуре T
можно записать в виде
, изменение энтальпии
(теплоту реакции при постоянном давлении) при полной конверсии реагентов
(νi < 0) в продукты (νi > 0) при заданной температуре T
можно записать в виде
![]() , (3.4)
, (3.4)
где ![]() измеряется в Дж/(моль вещества Аi), а парциальная молярная энтальпия
компонента Ai
при температуре T определяется соотношением
измеряется в Дж/(моль вещества Аi), а парциальная молярная энтальпия
компонента Ai
при температуре T определяется соотношением
![]() , (3.5)
, (3.5)
где ![]() - стандартная энтальпия образования
компонента Аi
при температуре T0 (берется из справочников);
- стандартная энтальпия образования
компонента Аi
при температуре T0 (берется из справочников); ![]() - стандартное изменение энтальпии при
изменении температуры от T0 до T без химической
реакции;
- стандартное изменение энтальпии при
изменении температуры от T0 до T без химической
реакции; ![]() - энтальпия фазового перехода (плавление,
испарение);
- энтальпия фазового перехода (плавление,
испарение); ![]() - поправка на давление (если давление
постоянно, но не равно атмосферному);
- поправка на давление (если давление
постоянно, но не равно атмосферному); ![]() -
поправка, связанная с изменением энтальпии в результате смешения (растворения)
компонента Аi (образование
смеси), обычно невелика.
-
поправка, связанная с изменением энтальпии в результате смешения (растворения)
компонента Аi (образование
смеси), обычно невелика.
Так как парциальная мольная энтальпия является функцией состояния, то вычисление изменения энтальпии системы в результате химической реакции можно проводить осуществляя переход из состояния «1» в состояние «2» по любому термодинамическому пути (это закон Гесса), для которого известны справочные данные об изменении энтальпии за счет химической реакции, фазового перехода и т.д.
Пример. Рассмотрим изменение энтальпии при переходе системы, состоящей из одного моля изопропилового спирта, из состояния 1 в состояние 2 в условиях атмосферного давления в результате химической реакции изопропилового спирта в соответствии со стехиометрическим уравнением
CH3-CHOH-CH3 ® CH3-CO-CH3 + H2
(жидкость при 298К) (газ при 443К) (газ при 443К)
Состояние
1: Р = 1 атм, Т = 298К, состояние 2: Р = 1 атм, Т =
443 К. Обозначим ![]() ,
, ![]() ,
, ![]() A.
A.
В данном случае путь 1-2 удобно разбить (заменить) на 3 интервала:
1) Фазовый переход
A1 (жидк., 298К) ® A1 (газ, 298К):
![]() Дж/(моль А1) (из
справочника);
Дж/(моль А1) (из
справочника);
2) Химическая реакция
A1 (газ, 298К) ® A2 (газ, 298К) + A3 (газ, 298К)
![]()
![]() Дж/(моль А1) (
Дж/(моль А1) (![]() - из справочника);
- из справочника);
3) Нагрев
A2 (газ, 298К) + A3 (газ, 298К) ® A2 (газ, 443К) + A3 (газ, 443К)
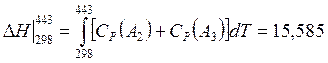 Дж/(моль А1) (СР
– из справочника).
Дж/(моль А1) (СР
– из справочника).
Ответ: ![]() Дж/(моль А1).
Дж/(моль А1).
Таким образом, при осуществлении рассматриваемого процесса в реактор необходимо подводить 116,127 Дж на каждый моль превращаемого изопропилового спирта.
3.3 Химическая кинетика
Кинетика - это наука о механизмах и скоростях протекания процессов. Химическая кинетика - наука о механизмах и скоростях химических реакций.
В зависимости от методов исследования и описания обычно выделяют три раздела химической кинетики:
- феноменологическая (формальная) кинетика, основанная на эмпирических подходах и прямых экспериментах по определению суммарных скоростей реакций как функций температуры и состава реакционной среды;
- теоретическая кинетика (вычисление значений констант скоростей и энергий активации реакций с использованием молекулярных постоянных на основе теории строения молекул их переходного состояния и статистической физики);
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.