![]() ,
, ![]() ;
; ![]() ;
; ![]() .
.
В этом случае скорость
изменения содержания i-го компонента (или концентрации в случае
изохорического процесса) в результате суммарной реакции определяется на основе
соотношений (3.9). Понятия скорости реакции (![]() ) и
скорости изменения содержания компонента (Ri = dni/dt, VdCi/dt – для изохорического процесса) являются очень важными
и часто используются при выводе уравнений математических моделей реакторов.
) и
скорости изменения содержания компонента (Ri = dni/dt, VdCi/dt – для изохорического процесса) являются очень важными
и часто используются при выводе уравнений математических моделей реакторов.
Единицы
измерения скорости реакции - моль/(л с), моль/(м3 с), 1/(м3 с) и т.д. Для
реакций, протекающих в газовой фазе, используют также и единицы давления
в единицу времени (мм.рт.ст./с, Па/с, Н/(м2 с) и т.д.), так как в
газе парциальное давление пропорционально мольной концентрации (для
идеальных газов ![]() , где постоянная Больцмана k
= 1,38 10-23 Дж/К,
, где постоянная Больцмана k
= 1,38 10-23 Дж/К, ![]() - концентрация молекул
в единице объема, [
- концентрация молекул
в единице объема, [![]() ] = м-3, [Pi] = Па).
] = м-3, [Pi] = Па).
Основными параметрами, определяющими скорость реакции, являются концентрации веществ, участвующих в реакции (Ci), и температура (T).
3.5 Закон действующих масс (зависимость скорости простой реакции от концентраций реагентов)
Необратимая реакция - реакция, идущая в одну сторону (продукты реакции не могут превращаться в исходные вещества). Зависимость скорости простой необратимой реакции от концентрации реагентов определяется законом действующих масс (Гульдберг и Вааге, 1864)
 , (3.10)
, (3.10)
(i = 1, ..., m - только исходные реагенты).
Здесь ![]() - константа скорости реакции (не зависит
от Ci), → (стрелка)
- обозначает величины, относящиеся к прямой реакции или к веществам,
участвующим в прямой реакции (исходным реагентам), показатель степени при
концентрации
- константа скорости реакции (не зависит
от Ci), → (стрелка)
- обозначает величины, относящиеся к прямой реакции или к веществам,
участвующим в прямой реакции (исходным реагентам), показатель степени при
концентрации ![]() называется порядком реакции по i-му
компоненту (в случае простой реакции
называется порядком реакции по i-му
компоненту (в случае простой реакции ![]() , так как для исходных
реагентов νi
<0).
, так как для исходных
реагентов νi
<0).
Закон
действующих масс имеет простое статистическое толкование. Действительно,
вероятность р нахождения одной молекулы в некотором малом объеме δV
пропорциональна концентрации этих молекул (p ~ Ci). Вероятность одновременного
нахождения ![]() молекул в объеме δV равна
произведению вероятностей нахождения там каждой молекулы, т.е.
молекул в объеме δV равна
произведению вероятностей нахождения там каждой молекулы, т.е. ![]() . Чтобы произошла реакция необходимо, чтобы
в объеме δV собралось ν1 молекул вещества A1,
ν2 молекул вещества A2 и так далее.
Следовательно, вероятность того, что соберутся одновременно все молекулы,
участвующие в элементарном акте реакции, (а, следовательно, и скорость реакции)
пропорциональна
. Чтобы произошла реакция необходимо, чтобы
в объеме δV собралось ν1 молекул вещества A1,
ν2 молекул вещества A2 и так далее.
Следовательно, вероятность того, что соберутся одновременно все молекулы,
участвующие в элементарном акте реакции, (а, следовательно, и скорость реакции)
пропорциональна 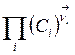 . Что и имеет место в (3.10).
. Что и имеет место в (3.10).
Обратимые реакции – это реакции, способные протекать как в прямом, так и в обратном направлении. Фактически в случае простой обратимой реакции в реакторе протекают две реакции: прямая (исходные реагенты превращаются в продукты) и обратная (продукты превращаются в исходные реагенты). Очевидно, что видимая скорость обратимой (суммарной) реакции будет равна алгебраической сумме скоростей прямой и обратной реакций
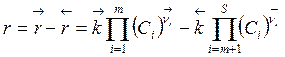 , (3.11)
, (3.11)
где ![]() ,
, ![]() -
константы скоростей прямой и обратной реакций, соответственно (не зависят от Ci), в первом слагаемом правой части уравнения
под знаком произведения находятся только концентрации исходных реагентов, во
втором - только концентрации продуктов реакции,
-
константы скоростей прямой и обратной реакций, соответственно (не зависят от Ci), в первом слагаемом правой части уравнения
под знаком произведения находятся только концентрации исходных реагентов, во
втором - только концентрации продуктов реакции, ![]() (νi < 0) – для исходных реагентов
(прямая реакция),
(νi < 0) – для исходных реагентов
(прямая реакция), ![]() (νi > 0) - для продуктов реакции
(обратная реакция).
(νi > 0) - для продуктов реакции
(обратная реакция).
Пример. Пусть имеем простую обратимую
реакцию 3A1
+ 2A2 ↔ A3 + 4A4 (стехиометрическое уравнение: -3A1 - 2A2 + A3
+ 4A4 = 0). Здесь ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
следовательно,
,
следовательно,
![]() [моль/(с·м3)].
[моль/(с·м3)].
Это реакция 3-го порядка по компоненту A1, 2-го порядка по A2, 1-го порядка по A3, 4-го порядка по A4 (показатель степени при концентрации i-го компонента называется порядком реакции по i-му компоненту).
Необходимо
отметить, что только в случае простых реакций порядок реакции
(показатель степени при концентрации) совпадает с абсолютным значением
соответствующего стехиометрического коэффициента. В общем случае сложных
реакций ![]() , более того иногда (например, в случае
гетерогенного катализа) зависимость скорости сложной реакции может
представляться в виде сложной дробной функции от концентраций исходных
реагентов и продуктов реакции.
, более того иногда (например, в случае
гетерогенного катализа) зависимость скорости сложной реакции может
представляться в виде сложной дробной функции от концентраций исходных
реагентов и продуктов реакции.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.