Опишите и объясните свои наблюдения и дайте сравнительную характеристику использованных катализаторов.
Опыт 2. Каталитическое действие воды. (Опыт проводится под тягой!).
В фарфоровую чашку насыпьте небольшое количество порошка цинка (магния) и примерно такое же количество мелко растертого йода. Смесь перемешайте стеклянной палочкой и убедитесь, что реакция практически не происходит. Перенесите чашку под тягу, добавьте 1 – 3 капли воды и наблюдайте бурно протекающую экзотермическую реакцию.
Запишите свои наблюдения, составьте уравнения химической реакции и оцените роль воды в этой реакции.
Опыт 3. Автокатализ.
В коническую колбу внесите 5 мл 2Н раствора щавелевой кислоты Н2С2О4, 5 мл 2Н раствора серной кислоты H2SO4 и 0,5 мл перманганата калия КМnО4. В момент внесения раствора КМnО4 включите секундомер. Непрерывно помешивая содержимое колбы, наблюдайте протекание химической реакции:
![]()
или
ионной форме: ![]()
Отметьте время окончания реакции по обесцвечиванию раствора.
Добавьте в ту же колбу еще 0,5 мл 2Н раствора КМnО4 и определите время реакции τ2. Добавьте в третий и четвертый раз по 0,5 мл раствора КМnО4, каждый раз измеряя время реакции. Убедитесь, что после каждого добавления 0,5 мл раствора КМnО4 протекает одна и та же реакция, но с разной скоростью. Установлено, что катализатором этой реакции являются образующиеся в ней ионы Мn2+, количество которых в смеси увеличивается после каждого внесения раствора КМnО4.
Результаты опыта занесите в таблицу 8.
Таблица 8
|
Внесение 2Н раствора КМnО4 в реакционную смесь |
Время реакции |
Относительная скорость |
Условное содержание Мn2+ в реакционной смеси в момент окончания реакции |
|
первое – 0,5 мл |
τ1= |
||
|
второе – 0,5 мл |
Τ2= |
||
|
третье – 0,5 мл |
Τ3= |
||
|
четвертое – 0,5 мл |
Τ4= |
Рассчитайте относительную скорость реакции и объясните ее изменения. Графически изобразите зависимость скорости реакции от содержания ионов Мn2+ в реакционной смеси.
Лабораторная работа №6
Химическое равновесие
Цель:
Рассмотреть обратимые реакции и факторы, влияющие на них.
Введение
Реакции, протекающие одновременно в двух противоположных направлениях и заканчивающиеся установлением химического равновесия, называют обратимыми реакциями:
![]() (11)
(11)
Химическим равновесием называют такое состояние системы, при котором скорости прямой и обратной реакции равны между собой. В состоянии химического равновесия реакции происходят, но концентрации веществ в системе не изменяются. В соответствии с законом действия масс химическое равновесие выражается уравнением
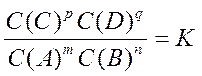 ,
,
где: С(А), С(В), С(С), С(D) – концентрации веществ при равновесии в системе, моль/м.
Константа равновесия К зависит от природы веществ, температура и давления, но не зависит от концентрации.
Изменение условий (концентрации реагирующих веществ, температуры и давления) в равновесной системе приводит к нарушению равенства скоростей и выводит систему из состояния равновесия. Однако через некоторое время скорости снова выравниваются, хотя и приобретают отличное от первого значение. Система приходит в новое состояние равновесия, характеризующееся той же константой равновесия, но иными равновесными концентрациями веществ. Переход системы из одного равновесного состояния в другое называют смещением химического равновесия. Направление смещения химического равновесия определяет принцип Ле-Шателье: если изменить одно из условий, при которых система находится в состоянии химического равновесия (концентрацию, температуру, давление), то в системе протекают процессы, ослабляющие производственное изменение. Например, если в равновесной системе (ур. 11) увеличить концентрацию вещества А, то увеличиться скорость прямой реакции, а это приведет к уменьшению концентрации вещества А, увеличению концентраций вещества С, D и к повышению скорости обратной реакции. Такое изменение в состоянии равновесия называют смещением равновесия вправо. Увеличение концентрации С или D, наоборот вызовет сдвиг равновесия влево.
Увеличение давления активирует реакции, идущие с уменьшением объема. Повышение температуры сместит равновесие в сторону эндотермической реакции, а охлаждение системы – в сторону экзотермической реакции.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.