Составьте структурные формулы молекул исследуемых веществ, укажите тип гибридизации атома углерода, оцените валентные углы.
Воспользуйтесь таблицей 1 и оцените полярность отдельных связей в молекуле, покажите смещение общих электронных пар.
Определите степень симметричности молекулы каждого из исследуемых веществ, сопоставьте полярность отдельных связей и молекулы в целом.
Сопоставьте теоретический вывод о полярности молекулы с практически полученными результатами.
Лабораторная работа№ 3
Определение теплового эффекта реакции нейтрализации
Цель:
Ознакомьтесь с методиками экспериментального определения и расчета теплового эффекта химической реакции.
Введение
При химических превращениях происходят глубокие качественные изменения в системе: рвутся старые связи и образуются новые. Эти изменения сопровождаются энергетическими эффектами: обычно это выделение или поглощение тепла. Выделение тепла при реакции свидетельствуют о том, что исходные вещества обладали большим запасом энергии в скрытой форме, чем конечные и наоборот.
Количество тепла, выделяемое или поглощаемое системой в ходе реакции, при проведении ее в условиях постоянной температуры и постоянного давления, отнесенное к взаимодействию такого числа молей вещества, которое указано в уравнении реакций, называется тепловым эффектом реакции (∆Н, кДж/моль).
Реакции, протекающие с выделение тепла, называют экзотермическими, их тепловой эффект считают отрицательным. Реакции, сопровождающиеся поглощением тепла, называют эндотермическими, а их тепловой эффект считают положительным. Например, разложение 1 моль карбоната кальция сопровождается поглощением 144,5 кДж тепла. Это значит, что тепловой эффект реакции ∆Н=+144,5 кДж/моль, а термохимическое уравнение реакции имеет вид:
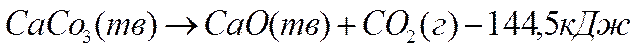 .
.
Тепловой эффект реакции образования одного моль химического соединения из простых вещество называется теплотой (энтальпией) образования данного химического соединения (∆Нf, кДж/моль). Так тепловой эффект реакции:
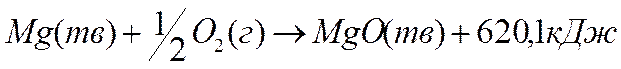 ,
,
называют теплотой образования оксида магния ∆Нf (МgО)= –620 кДж/моль.
Большое практическое значение имеет термохимический закон Г.И. Гесса: тепловой эффект химической реакции не зависит от того, протекает ли реакция в одну или несколько стадий, а зависит только от начального и конечного состояния реагирующих веществ. Иначе: суммарному тепловому эффекту другого ряда реакций, если исходные и конечные вещества одинаковы и находятся в одинаковом состоянии. Так реакцию нейтрализации серной кислоты можно осуществлять двумя путями:
– в виде стадии:
![]()
![]()
– в одну тадию;
![]()
Символ (аq) означает, что реакция идет в водном растворе. Согласно закону Гесса ∆Н3= ∆Н1+ ∆Н2.
В термохимических расчетах используют следствие из закона Гесса: тепловой эффект химической равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ с учетом стехиометрических коэффициентов. Так для реакции
![]() ,
,
тепловой эффект ∆Н=с∙∆Нf(С)+d∙∆Hf(D)–a∙∆Нf(A)–b∙∆Hf(B) (4)
Экспериментальная часть
Экспериментальный метод определения теплового эффекта химической реакции основан на измерении изменения температуры при протекании реакции в адиабатической системе. Для этой цели может быть использован упрощенный калориметр (рис.1), в корпусе (1) расположен сосуд Дьюара (2) под герметичной пробкой (3) с термометром (4). Цена деления термометра не превышает 0,1°С.
Тепловой эффект реакции рассчитывается по формуле:
![]()
где m=V∙ρ – масса реакционной смеси, г;
V и ρ – объем и плотность смеси, соответственно, см3 и г/см3;
с – удельная теплоемкость смеси, Дж/г·К;
∆t – изменение температуры при протекании химической реакции;
n - число молей вещества, вступившего в реакцию.
|
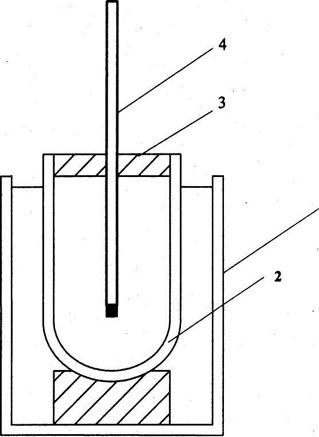
Рис. 1 Упрощенный калориметр.
Опыт 1. Нейтрализация серной кислоты в две стадии.
50 мл 1М раствора H2SO4 влейте в калориметр и герметично закройте его крышкой, предварительно убедившись, что шарик термометра погрузился в раствор. Измерьте температуру раствора H2SO4 – t1. В два химических стана налейте по 25 мл 2Н раствора NaOH. Для проведения первой стадии нейтрализации (ур.1) быстро, без потерь вылейте раствор NaOH из одного стакана в кислоту, герметично закройте крышкой калориметр и осторожно перемешайте. Постоянно наблюдайте за температурой в калориметре и запишите максимальную температуру раствора после нейтрализации – t1. Запишите в таблицу 3 (см. ниже) разность температур:
![]() и
объем полученного раствора NaHSO4 – V1.
и
объем полученного раствора NaHSO4 – V1.
Для проведения второй стадии нейтрализации (ур.2) запишите температуру раствора NaHSO4 в калориметре – t3. Быстро, без потерь влейте в калориметр раствор щелочи из второго стакана, перемешайте реакционную смесь и отметьте максимальную температуру второй стадии нейтрализации – t4. Запишите в таблицу разность температур ∆t2 = t3– t4 и объем полученного раствора NaHSO4 – V2.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.