Опыт 2. Нейтрализация серной кислоты в одну стадию.
В калориметр налейте 50 мл 1М раствора H2SO4, герметично закройте и измерьте температуру раствора – t5. Быстро, без потерь перенесите в калориметр 50 мл 2Н раствора NaOH, предварительно подготовленного в химическом стакане. Закройте калориметр, осторожно перемешайте и отметьте максимальную температуру после нейтрализации (ур.3) – t6. Запишите в таблицу разность температур ∆t3 = t5– t6 и объем полученного раствора Na2SO4 – V3.
Для расчета тепловых эффектов реакций по результатам опытов 1 и 2 воспользуйтесь уравнением.
![]() , (6)
, (6)
где 20 – коэффициент пересчета количества тепла на один моль взятой для нейтрализации кислоты;
0,001 – коэффициент пересчета в кДж.
Сравните значения ∆H3 ∆H1+ ∆H2.
Составьте термохимические уравнения для реакции нейтрализации в две и одну стадию.
Таблица 3.
|
Реакция |
Объем реакционной смеси, см3 |
Разность температуру, К |
Плотность г/см3 |
Теплоемкость, Дж/г·К |
Тепловой эффект реакции, кДж/моль |
|
Нейтрализации в две стадии |
|||||
|
Первая стадия |
V1= |
∆t1= |
Ρ1=1,10 |
С1=5,02 |
∆Н1= |
|
Вторая стадия |
V2= |
∆t1= |
Ρ2=1,12 |
С2=6,28 |
∆Н2= |
|
Нейтрализация в одну стадию |
V3= |
∆t1= |
Ρ3=1,12 |
С3=5,15 |
∆Н3= |
Рассчитайте теоретически тепловой эффект реакции нейтрализации (ур.3), применяя следствие из закона Гесса (ур.4) и теплоты образования исходных и конечных веществ в растворенном состоянии:
∆Нf (H2SO4) = –904, 50 кДж/моль, ∆Нf (NaOH) = –470,12 кДж/моль
∆Нf (Na2SO4) = –1403, 36 кДж/моль, ∆Нf (Н2О) = –285,84 кДж/моль
Вычислите ошибку в процентах экспериментального определения теплового эффекта реакции нейтрализации по сравнению с теоретически рассчитанным значением.
Лабораторная работа №4
Химическая кинетика
Цель:
Ознакомиться с методикой определения скорости химических реакций, определить влияние концентрации реагирующих веществ и температуры на скорость реакций.
Введение
Химической кинетикой называют учение о скорости химических реакций. Скорость реакций v выражается изменением концентрации реагирующих веществ ∆С в единицу времени ∆τ
![]() . (7)
. (7)
При расчете скорости реакций обычно пользуются молярными концентрациями (моль/л), а за единицу времени выбирают секунды минуты, часы в зависимости от скорости протекания реакции. На скорость реакции влияют природа веществ, их концентрация, температура, присутствие катализаторов, примесей. Зависимость скорости реакции от концентрации реагирующих веществ произведению концентраций реагирующих веществ. Так для реакции
![]() скорость
по закону действия масс равна
скорость
по закону действия масс равна
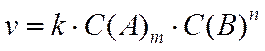 , (8)
, (8)
где С(А) и С(В) – концентрация реагирующих веществ А и В в данный момент времени;
k – константа скорости реакции.
При повышении температуры скорости реакций увеличивается: для большинства реакций повышение температуры t на 10 градусов вызывает увеличение скорости в 2–4 раза. Это увеличение скорости называют температурным коэффициентом γ. Тогда приведенное правило можно записать в виде равенства:
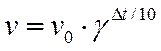 (9)
(9)
Различают гомогенные реакции – реакции между веществами, находящимися в одной фазе (жидкой или газообразной), и гетерогенные реакции – реакции между веществами, находящимися в разных фазах (твердой и жидкой, твердой и газообразной). В общем случае скорость гетерогенных реакций, кроме перечисленных факторов, определяет поверхность соприкосновения реакций, кроме перечисленных факторов, определяет поверхность соприкосновения реагирующих веществ: чем больше раздробленность фаз, тем больше поверхность соприкосновения и тем больше скорость реакции. Скорость взаимодействия порошков с жидкими или газообразными реагентами значительно выше, чем скорость взаимодействия последних с массивными кусками твердых веществ.
Экспериментальная часть
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.