Федеральное агентство по образованию
Санкт-Петербургский Государственный Университет
Низкотемпературных и Пищевых Технологий
Кафедра криогенной техники
Курсовая работа
На тему «Расчет установки для ожижения водорода»
Выполнил: Бельтюкова Е.А.
Гр. 4 ТФ
Преподаватель: Акулов Л.А.
Санкт-Петербург, 2009 г.
Содержание
Введение
Выбор схемы
Характеристики циклов ожижения водорода
Принципиальная схема ожижительной установки
Исходные данные
Расчет режима работы установки
Результаты расчета
Параметры потока в характерных точках процесса
Принцип работы установки
Список литературы
Введение
Существует три изотопа водорода: протий Н с массовым числом 1; дейтерий Д с массовым числом 2, тритий Т с массовым числом 3. В ядре атома протия один протон, дейтерия - протон и нейтрон, трития — один протон и два нейтрона, У всех изотопов по одному электрону. Протий и дейтерий стабильны. Период полураспада трития составляет 12,262 года; продуктом распада является Не-3
Известно несколько промышленных методов получения водорода. Наиболее экономичны методы получения Н2 из природного газа и газов, сопутствующих процессам добычи и переработки нефти (попутные газы). Содержащиеся в этих газах углеводороды (метан, пропан, бутан и др.) подвергаются так называемой каталитической конверсии с водяным паром.
 Первая
реакция протекает при температуре до 1073 К на никелевом катализаторе, вторая
при температуре около 773 К на окислах железа и хрома. Получаемый газ содержит
до 25 % смеси (СО + СО2), очисткой от которой завершается
процесс производства Н2. В
техническом водороде содержание примесей не должно превышать 2,0 — 2,5
%, Используют также метод неполного окисления углеводородов 95 % кислородом при
давлении около 4 МПа и температуре до 1773 К:
Первая
реакция протекает при температуре до 1073 К на никелевом катализаторе, вторая
при температуре около 773 К на окислах железа и хрома. Получаемый газ содержит
до 25 % смеси (СО + СО2), очисткой от которой завершается
процесс производства Н2. В
техническом водороде содержание примесей не должно превышать 2,0 — 2,5
%, Используют также метод неполного окисления углеводородов 95 % кислородом при
давлении около 4 МПа и температуре до 1773 К:
В крупнотоннажном производстве большие количества водорода получают также из газов, образующихся при переработке нефти- Например, газы каталитического реформинга могут содержать 40-80 % водорода, газы пиролиза этана — до 60 % водорода- Для получения из них водорода используют криогенные методы очистки. При получении водорода в сравнительно небольших количествах применяют электролиз воды. Однако, несмотря на высокую степень чистоты получаемого водорода (до 99,9 %), этот метод неэкономичен (расход электроэнергии достигает 60-70 кВт*ч на 1 кг Н2), Водород высокой чистоты (99,99 %) получают диффузионной очисткой палладием.
Во всех случаях в получаемом водороде содержится до 99,987 % атомов протия. Содержание атомов дейтерия колеблется от 0,013 до 0,016 %. Так как молекула водорода двухатомная, то большая часть атомов дейтерия соединена в молекулы с атомами протия, образуя так называемый водородный дейтерид НД, содержание которого составляет 0,026 — 0,032 %, Температура кипения НД около 22,13 К, поэтому его можно извлечь методом низкотемпературной ректификации. Впервые такой способ разделения разработан группой ученых под руководством проф. М.П. Малкова.
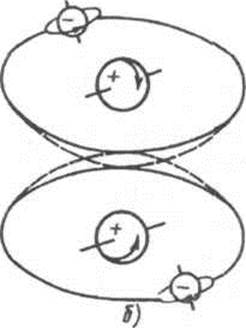
Орто-парасостав и орто-параконверсия водорода. Существуют две модификации водорода; ортоводород (о-Н2), параводород (п-Н2), Они различаются направлением вращения ядер, т.е. ядерными спинами (рис. 3.20). При разных температурах равновесный состав орто-парамодификаций различен:
|
Т, К ................................... 20,39 30 |
40 70 120 200 250 300
Доля молекул пара-
водорода в равновес
ном водороде, %................ 99,8
97,02 88,73 55,88 32,96 25.97 25,26 25,07
При обычных температурах водород представляет собой смесь 75 % ортомодификации (ядерные спины одного направления) и 25 % парамодификации (ядерные спины противоположных направлений); такой водород называют нормальным (см. табл. 3,2). С понижением температуры доля парамодификации увеличивается. При равновесии в жидком водороде содержится 99,8 % парамодификации и 0,2 % ортомодификации, т.е. равновесный жидкий водород практически является параводородом. Процесс орто-парапревращения называют орто-парапереходом или орто-параконверсией. В газообразном состоянии орто-параконверсия возможна только в присутствии катализаторов. В жидкой фазе она протекает самопроизвольно, весьма медленно. Например, ожиженный нормальный водород вначале имеет состав исходного газообразного водорода; доля молекул параводорода (хп,н ) увеличивается с течением времени.
Например, через 100 ч х,,_н составляет 0,595, а через 1000 ч — окало 0,92. Процесс конверсии сопровождается выделением теплоты. При низких температурах (15 К < Т < 70 К) теплота орто-параперехода примерно одинакова и составляет около 706 Дж/г; с повышением температуры она быстро уменьшается и, например, при 200 К составляет только 219 Дж/г. Общее количество теплоты, выделяющейся при орто-парапревращении (теплота конверсии от нормального состояния до равновесного), весьма значительна.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.