Коррозия Ме с водородной деполяризацией.
Процессы коррозии Ме, у которых катодная деполяризация осуществляется ионами водорода, принято называть коррозией Ме с водородной деполяризацией.
Водородная деполяризация т/д возможна в тех случаях, когда
(![]() )p<(
)p<(![]() )p=
)p= ![]() +
+![]() ln
ln![]() при
при
![]() =1, P=101
=1, P=101![]() ;
; ![]() =0 при всех
=0 при всех ![]()
Значения равновесных
потенциалов водородного эл-да в зависимости от рН и ![]() при 25 °С.
при 25 °С.
|
|
0 |
7 |
14 |
|
5,1кН/м2 (5⋅10-7аг) |
+0,186 |
-0,228 |
-0,641 |
|
101кН/м2 (1 аг) |
0 |
-0,414 |
-0,828 |
1. При достаточной активности Н+ в растворе(в кислых средах рН<7) коррозия многих Ме в растворах Н2SO4 и HCl к-т.
2.
При достаточно
электроотрицательных значениях потенциала Ме вследствии очень
отрицательных значений ![]() или при очень низкой активности ионов
или при очень низкой активности ионов ![]() в электролите.
в электролите.
корр. Мg в H2O, NaCl
корр. Pb, Sn в щелочах.
Процесс разряда ионов водорода в кислых, да и в щелочных и нейтральных средах довольно сложен. Состоит он из несколько последовательно протекающих стадий из которых наиболее замедленными считаются:
1.
![]() Разряд
ионов водорода H++e Haдс
Разряд
ионов водорода H++e Haдс
2.
![]() Рекомбинация
ионов водорода в молекулу Haдс+ Haдс H2
Рекомбинация
ионов водорода в молекулу Haдс+ Haдс H2
Поляризация катода возникает вследствии замедленности одной из этих стадий. Установлено, что другие стадии протекают с достаточно большой скоростью и лимитировать процесс в целом не могут(дифф. H3O+, дегидротиц.).
Концентрационная поляризация в данном случае невелика. Это объясняется высокой подвижностью ионов H+. Кроме того, у поверхности катода происходит постоянное перемеживание эл-та, вследствии выделения газообразного H2. При выделении H2 из щелочных и нейтральных растворов концентрационная поляризация должна быть низкой благодаря очень высокой концентрации разряжающихся частиц молекул воды.
Выделение же
водорода на катоде происходит при потенциале ![]() более отрицательном, чем обратимый потенциал
водородного электрода, отвечающий рН данного раствора.
более отрицательном, чем обратимый потенциал
водородного электрода, отвечающий рН данного раствора.
Мы только что
выяснили с вами, что величина концентрационной поляризации мала и ей можно
пренебречь. Следовательно, величина η=(![]() )р-(
)р-(![]() )р которую называют перенапряжением
водорода есть химическая поляризация.
)р которую называют перенапряжением
водорода есть химическая поляризация.
![]() р-η
р-η
![]()
![]()
η
![]()
![]() ik
ik
iк
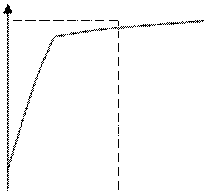
Под величиной перенапряжения водорода понимают сдвиг потенциала катода при данной плотности тока(iк) в отрицательную сторону по сравнению с потенциалом водородного электрода в том же растворе, в тех же условиях, но при отсутствии тока в системе.
Изучение водородного перенапряжения имеет большое практческое и теоретическое значение. Зная как и от каких факторов зависит величина η, можно увеличить ее, а следовательно уменьшить скорость коррозии.
Перенапряжение водорода связано с прохождением тока через катод и зависит от плотности тока.
η=а+в⋅lg iк (уравнение Гафеля установлено экспериментально в 1905г.)
а+в – постоянные, константы уравнения Гафеля.
а +η при iк = 1а/см2 зависит от материала катода, состояния поверхности, температуры и т.д. «а» изменяется в широких пределах от 0,1в (Pt) до 1,54в (Pb).
в – дает изменение перенапряжения при десятикратном изменении плотности тока, зависит от материала катода. Изменяется в пределах от 0,03 до 0,12 (иногда в>0,12 для окисленных и термических металлов).
Низкие значения в наблюдаются для металлов с малыми перенапряжениями (а – мала) Pt, Pd. Для большинства Ме, в том числе и для металлов с большим перенапряжением величина в=0,12 при 20°С.
Логарифмическая зависимость изменения потенциала катода от плотности тока сохраняется в широком интервале плотностей тока выше 10-2а/м2(Для некоторых металлов Pb, Pt в некоторой области плотностей тока наблюдается переход и новой полулогарифмической зависимости с измененным значением а и с тем же (Pb) или измененным (Pt) значением коэффициента в ).
При плотностях катодного тока меньше 10-2а/м2 зависимость перенапряжения водорода от плотности тока становится линейной.
η=к⋅i
Поскольку величина η зависит от плотности тока то при одинаковой силе тока, она будет больше на гладкой поверхности, чем на шероховатой при условии равенства истинных (геометрических) размеров катода.
Перенапряжение водорода уменьшается с ростом температуры, причем температурный коэффициент зависит от природы Ме и плотности тока. В среднем он сост. 1-н мв/град. Нижний предел, относится к металлам с низким перенапряжением, верхний – к Ме с высоким перенапряжением.
Перенапряжение водорода зависит от природы раствора и состава. Чем больше величина перенапряжения водорода у Ме , тем больше влияние состава. Наличие поверхностноактивных веществ изменяет величину перенапряжения.
Особенно большое влияние на η оказывает рН раствора. С уменьшением рН, η водорода в кислых средах уменьшается в щелочных возрастает.
Характерные особенности коррозии Ме с Н2Д
1. Незначительная зависимость от перемешивания;
2. Большая зависимость от рН раствора;
![]()
![]()
![]() а)
а) ![]() =
=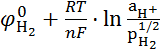 ;
; ![]() рН
рН ![]() .
.
![]()
![]() б) с уменьшением рН η в щелочных η в кислотных.
б) с уменьшением рН η в щелочных η в кислотных.
3. Чем ниже η на катодных примесях и чем больше их содержание, тем больше скорость коррозионного процесса(Cu, Sb, Cd, Zn,Pb).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.