Широкое распространение графического способа объясняется прежде всего тем, что поляризационные кривые можно получить опытным путем для более сложных случаев, соответствующих практическим условиям работы коррозионных элементов.
Нарисуем схему гальванической пары.
-
![]()
![]() +
+
 |

![]()
![]()
![]() R
R
φА φк
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Если цепь разомкнута R=∞; (φк)р и (φа)р
– собственно потенциалы электродов. Будем уменьшать сопротивление R I и если бы не было поляризации, то при R=0; I=∞.
Если цепь разомкнута R=∞; (φк)р и (φа)р
– собственно потенциалы электродов. Будем уменьшать сопротивление R I и если бы не было поляризации, то при R=0; I=∞.
![]()
![]() При R 0
I Imax. По мере увеличения тока вследствие явлений
поляризации эффективные потенциалы электродов будут сближаться.
При R 0
I Imax. По мере увеличения тока вследствие явлений
поляризации эффективные потенциалы электродов будут сближаться.
Наблюдаемая зависимость эффективных потенциалов электродов от силы тока, наз. Поляризационной диаграммой коррозии для данной коррозийной пары.
φ (φа)р 


![]()
![]()
![]()
![]()
φа
S
φк
(φк)р R
Imax I
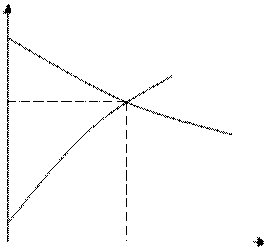
Т. к. R≠0, то мы не достигаем пересечения поляризационных кривых. Пересечение кривых можно получить при экстраполяризации последних. Точка пересечения кривых соответствует общему стационарному потенциалу системы: φx и Imax. Также системы наз. Полностью заполяризованными(короэкозамкнутыми). Поверхность изопотенциальна.
Второй способ построения поляризационных диаграмм заключается в том, что в независимых опытах получают анодные и катодные поляризационные кривые. По оси абсцисс откладывают I(Так для анода и катода общий а плотности тока разные).
 |
φ
(φа)р
S
Δ φа
Δ φк
(φк)р I
Imax
На поляризационной диаграмме графически находим значение Δφа и Δφк величины электродных поляризаций.
Если сопротивление двухэлектродной системы не рано «0», то графический расчет коррозионного процесса производят следующим образом.
По известному сопротивлению определяют омическое падение потенциала Δ φа. ΔφR=I⋅R
Графически эта зависимость изображается прямой с углом наклона φ. Δ φR=I⋅tgR α. Складываем омическое падение потенциала ΔφR с одной из поляризационных кривых, в направлении совпадающих с направлением соответствующих поляризаций.
![]() φ
φ
![]()
![]()
![]()
![]()


![]()
![]() α а
α а
φа M

![]()
![]() Δφа S
Δφа S
φк
![]() ΔφR
ΔφR
N
![]()
![]() α к
α к
![]()
![]()
![]() Δφк α R I
Δφк α R I
I Imax
Получаем кривую суммарного падения потенциала за счет(катодной) анодной поляризации и омического сопротивления.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.