Пересечение суммарной кривой с другой поляризационной дает точку, соответствующую току коррозии и эффективным потенциалам электродов.
Если зависимость для поляризуемости электродов линейная, то можно записать, что tg-сы углов наклона катодной и анодной прямых будут представлять поляризуемость электродных процессов в данной коррозионной системе.
tg α к=![]() tg α А=
tg α А=![]() .
.
Т.к. Δφа=![]() ⋅I Δφк=
⋅I Δφк=![]() ⋅I то
⋅I то ![]() ⋅I+
⋅I+![]() ⋅I+RI=(φк)р-(φа)р.
⋅I+RI=(φк)р-(φа)р.
I= ![]() т.е. графически получим ранее выведенную формулу
аналитической зависимости коррозионного тока.
т.е. графически получим ранее выведенную формулу
аналитической зависимости коррозионного тока.
Контролирующий процесс
Эффективность работы коррозионного элемента находится в прямой зависимости от двух величин степени т/д неустойчивости и величины общего кинетического торможения данной коррозионной системы.
Общий процесс электрохимической коррозии из нескольких последовательных стадий(анодного, процесса перетекания электрического тока и катодного процессов).
Установившаяся
скорость такого процесса соответствующая силе коррозионного тока I,
определяется торможением протекания тока на отдельных ступенях, т.е.
сопротивлением отдельных ступеней(![]() ,
,![]() ,
,![]() ). Инными словами можно сказать. Начальная разность
потенциалов(т/д неустойчивоть) расходуется на преодоление сопротивления
отдельных ступеней.
). Инными словами можно сказать. Начальная разность
потенциалов(т/д неустойчивоть) расходуется на преодоление сопротивления
отдельных ступеней.
I= ![]()
![]() ⋅I+
⋅I+![]() ⋅I+RI=(φк)р-(φа)= ΔφR+ Δφа+ Δφк.
⋅I+RI=(φк)р-(φа)= ΔφR+ Δφа+ Δφк.
Под степенью контроля общего процесса данной ступени понимают долю сопротивления этой ступени по отношению к общему сопротивлению всего процесса.
Са= ![]() =
=![]() ⋅100%. Са, Ск, СR
– степени анодного, катодного и омического контроля.
⋅100%. Са, Ск, СR
– степени анодного, катодного и омического контроля.
Контролирующим или ограничивающим процессом называют ту ступень процесса, которая имеет наибольшее сопротивление по сравнению с действительными ступенями. Т.е. имеющую основное влияние на скорость коррозии Ме.
Для определения контр. Процесса нужно сравнить Са, Ск и СR или Δφа, Δφк и ΔφR.
Основные практические случаи контроля электрохимической коррозии
В практических условиях встречается шесть основных случаев контроля э.хим. коррозии. Для них мы и приведем поляризационные диаграммы.
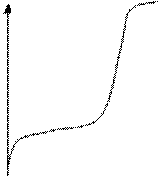 |
![]()
![]()
![]()
![]()
![]()
![]()
![]() R≈0
R≈0

![]()
![]()

![]()
![]()
![]()
![]()
![]()


![]()
![]()

![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() φxφx
φxφx
Δφа
Δφк
Imin Imax Imax
φx
Imax I I
1.
Катодный контроль при основной
роли перенапряжения ионизации О2 R=0 Δφк
>> Δφа ![]() >>
>> ![]() (поляризуемость дифф. И электродной реакции)
(поляризуемость дифф. И электродной реакции)
При коррозии Ме в нейтральных эл-тах при хорошем подводе О2 к корродирующему.
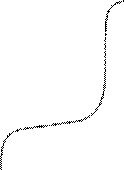
2.
Катодный контроль при основной
роли диффузии О2 R≈0; Δφа << Δφк ;
![]() <<
<<
![]()
3. Катодный контроль: при основной роли перенапряжения Н2.
R≈0 ;
Δφк >> Δφа ;
![]() >>
>> ![]() . Fe, Zn и
др. Ме в растворах неокисляющих к-т.
. Fe, Zn и
др. Ме в растворах неокисляющих к-т.
4. Смешанный анодно-катодный контроль R=0 ; Δφа ≈ Δφк Fe, Al, нерж. стали в пассивном состоянии.
5. Смешанный катодно-анодный контроль R≠0 ; Δφк ≈ ΔφR >> Δφа.
При работе микропар в р-рах с низкой электропроводимостью или большим межполюсным расстоянием. Подземный трубопровод с неравномерной аэрацией.
6. Смешанный катодно-анодно-омический контроль Δφк ≈ ΔφR ≈ Δφа
При хорошем доступе О2 к поверхности Ме способного пассивироваться и при большом сопротивлении эл-та.
Атмосферная коррозия сталей под очень тонкой пленкой влаги.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.