где S- условное обозначение суммы. Например, для реакции
аА + bВ ® сС + dD,
rН°реак. = (arН° сгор.A + brН° сгор.B) -(crН° сгор.C + drН° сгор.D),
где А, В и С, D – исходные вещества и продукты реакции, соответственно;
а, b, с, d - соответствующие стехиометрические коэффициенты в уравнении реакции;
Стандартные значения энтальпий сгорания - rН°сгор. также помещаются в соответствующие справочники [3]. В наших расчетах использовать эти величины нет необходимости.
Значения DН°обр. и DН°сгор., помещенные в таблицы термодинамических характеристик, представляют собой систему взаимосогласованных величин. Поэтому замена ранее известных значений этих величин на вновь экспериментально найденные более точные значения, влечет за собой пересмотр таких значений для всех других веществ, связанных с веществом, для которого эта замена была проведена.
2.2. Зависимость энтальпии химических реакций
от температуры. Уравнение Кирхгофа
Значения энтальпий химических реакций, а значит и их тепловых эффектов, зависят от природы участвующих в реакции веществ и от условий, в которых протекает реакция, в частности, от температуры.
В первом приближении можно принять, что изменения температуры слабо влияют на величину rН°реак.. Невысокую чувствительность энтальпий химических реакций к изменению температуры можно продемонстрировать на примере следующей реакции:
C(графит) + СО2(г) = 2СО(г),
для которой rН°773 = 173,9 кДж, а rН°1773 = 165,5 кДж, т.е. изменение температуры на 1000 К изменяет тепловой эффект реакции всего на 8, 4 кДж, что составляет ≈ 5 % от усредненной величины энтальпии реакции. Значительная часть термохимических данных экспериментально определяются с такой погрешностью.
Однако, в общем случае при больших изменениях температуры нельзя принимать rН°реак. ≈ const; в некоторых процессах, в частности, для реакций, протекающих в растворах, изменение rН°реак. с изменением температуры может быть значительными и в небольшом интервале температур. Эти изменения определяются изменением теплоемкостей реагирующих веществ при протекании реакции - Dс, т.е. они будут тем больше, чем больше сумма теплоемкостей продуктов реакции отличается от суммы теплоемкостей исходных веществ. в 1858 г. Г.Р. Кирхгоф предложил уравнение, позволяющее рассчитать зависимость величины энтальпии реакции от температуры. Дифференциальная форма уравнения Кирхгофа имеет вид
drН°реак./dT= Dс, (4)
где Dс – изменение теплоемкости при превращении исходных веществ в продукты реакции. Интегрирование уравнения Кирхгофа в заданном интервале температур дает выражение
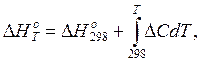 (5)
(5)
где
![]() и
и ![]() -
энтальпии реакции при заданной (Т) и стандартной температурах.
-
энтальпии реакции при заданной (Т) и стандартной температурах.
Различают теплоемкость вещества в изохорных условиях - СV при постоянном объеме (для процессов, протекающих в закрытых объемах, например в автоклавах) и теплоемкость в изобарных условиях - СР, т.е. в наиболее распространенном случае – при постоянном давлении. В наших расчетах используется стандартная изобарная теплоемкость - ѰРи ее изменение - Dс°Р.
Типичная зависимость теплоемкости вещества в разных агрегатных состояниях от температуры представлена на рисунке 1. Обычно, температурную зависимость теплоемкости выражают уравнением степенного ряда:
С°Р= а +bT + cT-2, (6)
где a, b, c– коэффициенты, определяемые по результатам экспериментальных измерений или вычисляемые методами статистической термодинамики. Величины этих коэффициентов приведены в справочниках, таких как [3], а для составляющих наших физико-химических систем даны в таблице 2 (Приложение 1).
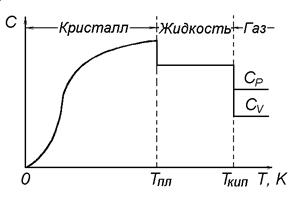
Рисунок 1. Зависимость теплоемкости вещества от температуры
Из рисунка 1 видно, что наиболее сильная температурная зависимость теплоемкости характерна для кристаллического состояния. При плавлении теплоемкость скачкообразно уменьшается и в жидком состоянии практически не изменяется с температурой. Теплоемкость газообразного состояния вещества, как правило, ниже теплоемкости его жидкости, тоже слабо зависит от температуры, но существенно различается для изобарных (СР) и изохорных (СV) условий. У идеального газа эти теплоемкости различаются на величину универсальной газовой постоянной R = 8,31 Дж/(моль·К):
СР = СV + R.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.