С увеличением температуры константа диссоциации воды возрастает, соответственно увеличивается и концентрация водородных ионов, а рН уменьшается. Поэтому когда указывается точная концентрация водородных ионов в растворе или оптимальный рН какой-либо химической реакции, должна быть указана и температура, к которой эта величина относится, иначе сведения носят лишь приблизительный характер.
Способность молекул вещества диссоциировать с образованием ионов водорода или гидроксила зависит от концентрации водородных ионов: чем она больше (т.е. рН ниже), тем менее диссоциированы кислоты и сильнее диссоциированы основания. Целый ряд веществ, переходя из недиссоциированного состояния в ионизированное, меняет цвет, поэтому окраска раствора зависит от рН. Такие вещества называются кислотно-щелочными индикаторами, область значений рН, в которой происходит изменение цвета, называется зоной перехода. Обычно она около 2 единиц - при изменении концентрации водородных ионов в 100 раз во столько же раз меняется соотношение диссоциированной и недиссоциированной форм индикатора, на глаз это воспринимается как полное изменение цвета. Вне зоны перехода окраска индикатора стабильна. Многие химические реагенты, используемые в клинической лабораторной диагностике при проведении цветных реакций - например, бромкрезоловый зеленый или п-нитрофенол - одновременно являются индикаторами, поэтому небольшое изменение рН заметно сказывается на оптической плотности раствора.
Абсолютная концентрация водородных ионов в нейтральных растворах ничтожна, случайное попадание небольшого количества кислоты или щелочи может очень сильно сказаться на величине рН. Чтобы сделать ее более устойчивой, используют смеси слабых кислот (или оснований) и их солей - так называемые буферные растворы, рН которых зависит от соотношения диссоциированной (соль) и недиссоциированной (слабая кислота или основание) форм.
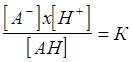 |
где АН - кислота в недиссоциированной форме, А- - анион кислоты, Н+- водородный ион, К - константа диссоциации кислоты.
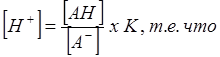 |
концентрация водородных ионов определяется соотношением концентраций диссоциированной и недиссоциированной форм кислоты. Так как слабые кислоты мало диссоциированы, а их соли хорошо диссоциированы, то, смешивая в разных соотношениях кислоту и ее соль, можно получить раствор, в котором концентрация водородных ионов в несколько раз больше или меньше, чем константа диссоциации кислоты.
Оптимальными буферными свойствами обладают растворы, в которых количества недиссоциированной кислоты и ее аниона (т.е. соли) примерно одинаковы. Когда к нему добавляют немного кислоты (т.е. ионов Н+) они связываются присутствующими в растворе анионами буферного вещества А-, в результате чего концентрация АН возрастает, а концентрация А- соответственно уменьшается, однако, соотношение этих форм меняется мало, соответственно, мало изменяется и рН. Если же добавляется щелочь, т.е. ионы гидроксила ОН- , то, наоборот, количество АН уменьшается, а диссоциированной формы А возрастает, поскольку водородные ионы связываются гидроксильными с образованием воды Н2О.
Рассмотрим, как реализуются буферные свойства при добавлении к раствору небольшого количества щелочи, которое обозначим [В]. Очевидно, что в этом случае концентрация кислоты уменьшится на то же количество миллимолей, что было добавлено щелочи, и теперь в растворе будет присутствовать не [АН] недиссоциированной кислоты, а [АН]-[В].
Так как вся кислота, нейтрализованная прибавленной щелочью, превратилась в соль, то количество соли увеличилось на ту же величину, на которую уменьшилось количество кислоты, т.е. теперь ее стало не [А-], а [А-]+[В]. В данном случае концентрация соли выражается тем же символом [А-], что и концентрация аниона кислоты, так как соль целиком диссоциирована.
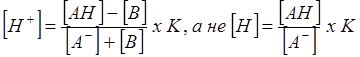 |
как было до прибавления щелочи.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.