Примечание. Наряду с реакцией дегидрирования, с небольшой скоростью может идти и реакция дегидратации. Первые два пика на хроматограмме – это её продукты: пропилен и диизопропиловый эфир. Пик, направленный вниз, относится к водороду. Следующие два пика – это ацетон и изопропанол. Следующий небольшой пик – ещё один побочный продукт.
Для расчёта константы равновесия реакции дегидрирования следует определить концентрацию изопропанола в исходной смеси исходя из табличных данных о зависимости давления паров изопропанола от температуры сатуратора. Следует учесть, что продукт реакции (водород) уже содержится в исходной реакционной смеси. Его доля в исходной смеси 10%. Концентрация водорода в продуктах реакции складывается из водорода содержащегося в ИРС и водорода образовавшегося при разложении изопропанола. Изменением объёма реакционной смеси при протекании реакции можно пренебречь, поскольку концентрация спирта в ИРС мала.
Задача Хр-1.
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ РАВНОВЕСИЯ
РЕАКЦИИ ДЕГИДРИРОВАНИЯ ИЗОПРОПАНОЛА.
Тренировка катализатора. Для хромита меди и CuSi тренировка в смеси 10% водорода в Не, нагрев 2 К/мин до 300 С, 2 часа. Охлаждение в смеси 50 С и закрыть реактор. CuSi более активен, чем хромит меди.
Реакция дегидрирования изопропанола на медно-хромовом катализаторе исследуется при температурах 130, 150 и 170 °С. Диапазон температур может изменяться в зависимости от используемого катализатора.
(СН3)2СН-ОН = (СН3)2С=О + Н2.
В этой области температур отчетливо проявляется обратимость реакции.
Цель лабораторной работы – определение константы равновесия Кр при двух–трёх температурах в указанном диапазоне; определение DrН0 реакции; расчёт DrН0 и Kр по справочным данным.
Для выполнения курсовой работы можно рекомендовать: определение зависимости константы равновесия от температуры и определение DrН0 реакции; сопоставление констант равновесия определенных при проведении реакции в прямом и обратном направлении. В последнем случае реагентами являются пары ацетона и смесь 10–15 % водорода в гелии.
Определение константы равновесия дегидрирования изопропанола
Константа равновесия реакции (СН3)2СНОН = (СН3)2СО + Н2 равна
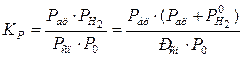 , (11)
, (11)
где Рац и Рсп
– давление паров ацетона и спирта в смеси продуктов реакции; ![]() и
и ![]() –
давление водорода в ИРС и СПР, P0 –
давление соответствующее стандартному состоянию, т. е. 1 атм. Для упрощения
расчётов можно считать, что концентрация спирта и ацетона в ИРС и СПР
пропорциональна площади хроматографических пиков, различием калибровочных
коэффициентов для ацетона и изопропанола можно пренебречь, т.к. они близки.
–
давление водорода в ИРС и СПР, P0 –
давление соответствующее стандартному состоянию, т. е. 1 атм. Для упрощения
расчётов можно считать, что концентрация спирта и ацетона в ИРС и СПР
пропорциональна площади хроматографических пиков, различием калибровочных
коэффициентов для ацетона и изопропанола можно пренебречь, т.к. они близки.
Обработка результатов.
Концентрация спирта в исходной смеси может быть найдена по известной температуре Тсат, если воспользоваться справочными данными о давлении насыщенных паров спирта. Зависимость давления паров изо-пропанола от температуры приведена в табл. 1. Значения давления паров при промежуточных температурах можно рассчитать, используя уравнение Клаузиуса–Клапейрона.
Таблица 1
Зависимость давления пара изо-пропанола от температуры
|
P мм рт ст. |
1 |
10 |
40 |
100 |
760 |
|
Т оС |
– 26,1 |
2,4 |
23,8 |
39,5 |
82,5 |
Если система не достигла равновесного состояния, то величина, вычисленная по уравнению (11), не есть константа равновесия. В этом случае она называется произведением реакции. При увеличении времени контакта реагентов с катализатором произведение реакции стремится к константе равновесия. Таким образом, для определения KР нужно знать начальное давление паров спирта и исследовать зависимость степени превращения от времени контакта. Для определения константы равновесия следует использовать данные, полученные при больших временах контакта (маленьких скоростях потока), когда концентрации реагентов мало меняются при изменении времени контакта.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.