МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет естественных наук
ХИМИЧЕСКОЕ РАВНОВЕСИЕ И
НЕОБРАТИМАЯ РЕАКЦИЯ В ОТКРЫТОЙ СИСТЕМЕ.
ГАЗОВАЯ ХРОМАТОГРАФИЯ
Методическое пособие
(исправленный вариант, 2010 год)
Новосибирск
2005
Методическое пособие содержит описание двух лабораторных работ, выполняемых в практикуме по физической химии.
Предназначено для студентов 3-го курса факультета естественных наук Новосибирского государственного университета.
Составители
канд. хим. наук, доц. В. А. Рогов,
канд. хим. наук М. В. Лузгин
Рецензент
д-р хим. наук Е. П. Талзи
©Новосибирский государственный
университет, 2005
Основные понятия и уравнения
Константа равновесия. Уравнение химической реакции можно записать в общем виде, как
![]() ,
,
где Ai – реагенты, ni – стехиометрические коэффициенты. Для исходных веществ ni отрицательны, для продуктов ni положительны. В состоянии равновесия алгебраическая сумма химических потенциалов реагентов с учётом стехиометрических коэффициентов равна нулю [1]:
![]()
Для реакции между идеальными газами зависимость химических потенциалов от давления имеет вид
![]() ,
,
P0– давление соответствующее стандартному состоянию, т. е. 1 атм. или 105 Па. Таким образом, условие равновесия для смеси реагирующих идеальных газов можно записать как
![]()
или
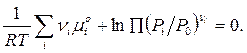
Вводя обозначения для
стандартного изменения энергии Гиббса ![]() и
и ![]() для константы равновесия химической реакции
можно получить известное соотношение
для константы равновесия химической реакции
можно получить известное соотношение
![]() (1)
(1)
Отсюда видно, что расчёт
константы равновесия сводится к вычислению ![]() . Если
температура равна 298 К, то расчёт тривиален. При иной температуре
. Если
температура равна 298 К, то расчёт тривиален. При иной температуре ![]() можно найти двумя способами. Можно
рассчитать
можно найти двумя способами. Можно
рассчитать ![]() и
и ![]() , используя
уравнение Кирхгофа и соответствующее уравнение для зависимости энтропии
реагентов от температуры, а затем найти
, используя
уравнение Кирхгофа и соответствующее уравнение для зависимости энтропии
реагентов от температуры, а затем найти ![]() . Другой
способ – применение метода Темкина–Шварцмана, т. е. использование
соотношения
. Другой
способ – применение метода Темкина–Шварцмана, т. е. использование
соотношения
![]() .
.
Здесь Dra, Drb, Drс и Drс’ – алгебраические суммы соответствующих величин с учётом стехиометрических коэффициентов, а величины М0, М1, М2, и М–2берутся из справочника (см., например, [2]).
Зависимость константы равновесия от температуры.Рассмотрим более подробно зависимость константы равновесия от температуры. Дифференцируя соотношение (1) по температуре при P = const и учитывая, что
![]() ,
(2)
,
(2)
легко получить уравнение
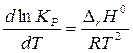 ,
(3)
,
(3)
называемое изобарой химической реакции или изобарой Вант–Гоффа. Стандартное изменение энтальпии в химической реакции DrН0 зависит от температуры. Эта зависимость определяется уравнением Кирхгоффа
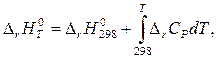 (4)
(4)
где DrН0298 – тепловой эффект реакции при Т = 298 К, а DrСР – алгеб-раическая сумма теплоёмкостей реагентов, взятая с учётом стехиометрических коэффициентов. Поскольку зависимость теплоёмкости от температуры принято описывать полиномом, то DrСР можно рассчитать по справочным данным, как
![]() . (5)
. (5)
Стандартное изменение энтропии в химической реакции при темпера- туре Т рассчитывается аналогично
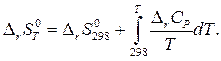 (6)
(6)
Подставляя выражения (4) и (6) в формулу (2) находим значение стандартного изменение свободной энергии Гиббса в химической реакции.
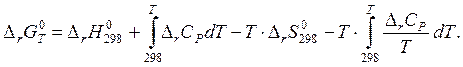 (7)
(7)
Ясно, что зависимость DrG0T от температуры может быть представлена в виде, совпадающем с уравнением Тёмкина–Шварцмана, в котором коэффициенты Mi зависят только от температуры:
![]() .
(8)
.
(8)
Получим для примера явное выражение для коэффициента M0. Вычисление интегралов содержащих Dra в выражении (7) дает следующий вклад в DrG0T:
Dra×(T – 298) – Dra×T×ln(T/298)= – T×Dra [– (T – 298)/T + ln(T/298)]. (9)
Сравнивая (8) и (9) видим, что
M0 = [– (T – 298)/T + ln(T/298)].
Остальные коэффициенты Mi также легко вычисляются.
Газожидкостная хроматография
Газожидкостная хроматография (ГЖХ) – один из основных способов исследования состава смесей. Современные приборы позволяют за 20-30 минут выполнить качественный и количественный анализ сложных смесей, например, моторных топлив. В практикуме по аналитической химии студенты факультета естественных наук имеют возможность детально ознакомиться с методом ГЖХ. Нижеследующее короткое описание принципов хроматографии и конструкции хроматографа достаточно для выполнения данной лабораторной работы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.