Так как компонент, обладающий меньшим давлением пара, кипит при более высокой температуре, кривые жидкости и пара на изобарической диаграмме меняются местами, т. е. кривая пара проходит выше кривой жидкости, поэтому область диаграммы, лежащей ниже кривой жидкости, отвечает жидкому состоянию, а область выше линии пара - парообразному. Между кривыми жидкости и пара лежит гетерогенная область, т. е. область сосуществования двух фаз. В качестве примера рассмотрим рисунок. Например, фигуративной точке системы Е с составом е (х2= е) и температурой кипения Т соответствуют две равновесные фазы (так как точка Е лежит в гетерогенной области) - жидкость состава а и пар состава b. Знаки производных ∂T/∂x2 и ∂P/∂x2противоположны, т. е. при увеличении содержания более летучего компонента 2 в растворе (от состава а до а1) давление пара над раствором возрастает, а температура кипения раствора понижается (от Т до T1). Соответственно пар богаче тем компонентом, прибавление которого к смеси уменьшает температуру кипения при данном давлении. В случае азеотропных смесей там, где на кривой давление-состав имеется max, на кривой температура кипения-состав находится minи наоборот.
Различие в составах паровой и жидкой фазы используется для разделения растворов на чистые компоненты и для очистки загрязненных веществ. Способность систем к разделению удобно выражать величиной относительной летучести компонентов а (коэффициент разделения). Относительная летучесть показывает, во сколько раз отношение концентраций компонентов в паре больше чем в жидкости
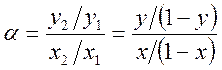 .
.
При этом принято брать отношение мольной доли более летучего компонента к мольной доле менее летучего.
В системах, не имеющих азеотропов, при ∂P/∂x2>0 величина α всегда больше единицы, так как согласно первому закону Коновалова y2> x2, а y1< x1 .
Используя законы Дальтона и Рауля, легко показать, что в идеальном растворе величина а = Р2°/Р1° = const, т.е. коэффициент разделения не зависит от состава. В реальных растворах при наличии в системе азеотропа величина а может быть меньше 1, а в самой точке азеотропа α = 1, так как y2 = x2, y1 = x1. разделение раствора в этом случае на чистые компоненты невозможно.
Методы изучения зависимости давления пара от температуры
При изучении равновесий жидкость-пар необходимо точно определить температуры кипения и составы сосуществующих фаз.
Для изучения зависимости Р от Т в однокомпонентных системах наиболее широко применяют два метода: определение давления пара при заданной температуре (статический метод) и измерение температуры кипения при постоянном давлении (динамический или эбулиометрический метод). Несмотря на принципиальную равноценность, оба метода сильно отличаются в методическом отношении.
Статический метод. Принцип измерения давления пара статическим методом заключается в том, что ёмкость с исследуемой жидкостью помещают в термостат и с помощью манометра измеряют равновесное давление пара. При этом из системы удаляют воздух, присутствие которого повышает измеряемое давление. Для этого жидкость замораживают во избежание испарения и откачивают воздух. Повторением процедуры замораживание-откачка-размораживание 3-4 раза удается снизить давление посторонних газов в системе до величин, меньших 0,001 мм ртутного столба.
Эбулиометрический метод. Точное определении температуры кипения жидкости при Р = constсопряжено с рядом трудностей, обусловленных тем, что нижние слои жидкости обычно бывают перегреты, а пар в верхних частях прибора может быть переохлажденным. Для устранения этих трудностей применяются приборы, называемые эбулиометрами. Чаще всего применяют эбулиометр Свентославского, представляющий собой циркуляционный прибор, в котором измеряется температура жидкости, конденсирующейся на шарике термометра. Эбулиометрический метод применяется при исследовании жидкостей, кипящих без разложения.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.