![]() . (4)
. (4)
Отсюда 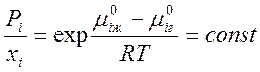 при постоянной Т. Таким образом, Pi= const .xi , причём легко видеть, что const= Pi° . Видно, что закон Рауля является следствием соотношения (4).
при постоянной Т. Таким образом, Pi= const .xi , причём легко видеть, что const= Pi° . Видно, что закон Рауля является следствием соотношения (4).
Для бинарного раствора закон Рауля можно представить в следующем виде:
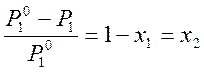 .
.
Относительное понижение давление пара растворителя над раствором равно мольной доле x2растворённого вещества. Общее давление пара над раствором равно сумме парциальных давлений:
![]() ,
,
т. е. давление пара линейно зависит от состава раствора.
Из закона Рауля следует, что зависимость общего давления пара от состава идеального раствора выражается прямой линией. В реальных предельно разбавленных растворах для растворителя выполняется закон Рауля, а для растворённого вещества выполняется закон Генри:
Р2=Кгх2 ,
где Кг - константа Генри. В идеальных растворах закон Генри совпадает с законом Рауля ( Кг = Р2° ). В реальных растворах могут наблюдаться различные отклонения от закона Рауля.
Поведение реального раствора тем существеннее не подчиняется законам идеальных растворов, чем больше различие между компонентами в отношении размера, формы и энергии взаимодействия молекул. Для неидеальных растворов общее давление пара уже не является линейной функцией состава раствора.
Давление пара над реальным раствором может быть как больше аддитивной величины (положительное отклонение от закона Рауля), так и меньше (отрицательное отклонение).
Вид диаграмм Р-х (при Т = const) для реальных растворов изображен на рис. 2. Причины отклонений от закона Рауля можно объяснить следующим образом: если разнородные молекулы в растворе взаимодействуют слабее, чем однородные, то переход компонентов раствора в газовую фазу облегчается по сравнению с чистыми жидкостями и наблюдается положительное отклонение от идеальности (вода-бензол, сероуглерод-ацетон, вода-метиловый спирт и т. д.). В обратном случае наблюдается отрицательное отклонение от закона Рауля (пиридин-уксусная кислота, ацетон-хлороформ и т. д.)
|
|
Рис. 2. Отклонение от закона Рауля для реальных растворов: / - положительное отклонение; 2 — отрицательное отклонение
Причинами более сильного взаимодействия молекул в растворе по сравнению с чистыми веществами могут быть образование водородных связей, сольватация, образование химического соединения и т. д. Существуют растворы, в которых знак отклонения от закона Рауля меняется с изменением концентрации.
Для реальных растворов уравнение (3) не выполняется. Для того, чтобы сохранить выражение для химического потенциала компонента в реальном растворе таким же, как в идеальном, Льюис предложил представить химический потенциал i-го вещества в виде
μi =μi0+RΤ lnаi , (5)
где аi - активность i-ro компонента в растворе; μi° - стандартный химический потенциал. Это выражение служит определением активности вещества в растворе. Величина активности определяется выбором стандартного состояния, в качестве которого для растворов неэлектролитов чаще всего выбирают чистое вещество (необходимо указать также его агрегатное состояние). При таком выборе стандартного состояния активность чистого компонента равна 1. Это такое же стандартное состояние, что и для идеального раствора.
В идеальном растворе аi = хi и уравнение (5) переходит в уравнение (3). Используя уравнение (5), можно для реального раствора получить термодинамические уравнения, которые будут иметь тот же вид, что и уравнения для идеального раствора, но место мольной доли компонента хi в них будет занимать его активность ai .
Введем коэффициент активности γi , связывающий активность компонента с его мольной долей
γi =αi/хi .(6)
Величина yiтоже определяется выбором стандартного состояния. Если за стандартное состояние выбрано чистое вещество, то коэффициент активности чистого вещества равен 1.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.