Переход dniмолей компонента из одной фазы (‘) в другую (“) в рассматриваемых условиях вызывает изменение изобарного потенциала dG, которое складывается из изменений изобарных потенциалов обеих фаз dG’и dG”:
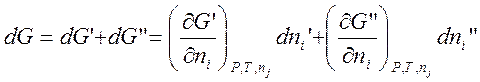 .
.
Так как dni’=-dni”, это соотношение можно переписать в виде
![]() .
.
Если система находится в состоянии равновесия, то свободная энергия системы достигает минимума и перенос бесконечно малого количества вещества из одной фазы в другую не меняетсвободную энергию системы. Как видно из последнего соотношения, это возможно, только если μi" - μi'. Или, в случае равновесия нескольких фаз,
μi' = μi'' = μi''' =...
Таким образом, в состоянии равновесия химические потенциалы каждого из компонентов одинаковы во всех фазах.
Фазовые равновесия в однокомпонентной системе.
В связи с постоянством состава однокомпонентной системы химический потенциал индивидуального вещества совпадает с мольной энергией Гиббса. В однокомпонентной системе условием равновесия между двумя фазами при постоянстве давления и температуры является равенство мольных энергий Гиббса компонентов в сосуществующих фазах. Если температура изменяется при постоянном давлении или давление изменяется при постоянной температуре, то равновесие нарушается и одна из фаз исчезает.
Условие сосуществования двух фаз при одновременном изменении давления Р и температуры Т задаётся уравнением Клапейрона
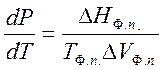 , (1)
, (1)
где ΔΗф.п. - мольная энтальпия равновесного фазового перехода (например, испарения), ΔVф.п. - разность мольных объёмов фаз, находящихся в равновесии.
В случае равновесия жидкость-пар уравнение (1) можно упростить, считая, что мольным объёмом жидкой фазы можно пренебречь по сравнению с мольным объёмом пара. Подставляя в уравнение (1) ΔVф.п. = (Vnap-Vж) ≈ Vпар = RT/P, получаем уравнение Клаузиуса-Клапейрона
|
|
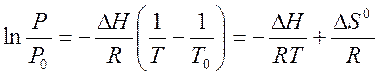 |
Здесь Ρ0 и Т0 - фиксированные значения температуры и давления, при которых возможно равновесие жидкость-пар. Если выбрать Ро = 1 атм, то Т0 - это нормальная температура кипения, аΔS0 = ΔН0/ Т0 - энтропия испарения при нормальной температуре кипения.
Уравнение даёт зависимость Р от Т на линии равновесия фаз. По этому уравнению можно рассчитать энтальпию испарения, исходя из значений давления пара при двух разных температурах Т и Т0. Зависимость давления насыщенного пара от температуры в координатах (ΙnΡ)-(1/Τ), представляет собой прямую линию, из наклона которой можно определить ΔНисп.
Фазовые равновесия в многокомпонентной системе. Растворы неэлектролитов.
Раствор - это гомогенная смесь переменного состава. Различают жидкие и твёрдые растворы, при этом термин «раствор» не содержащий уточнений, относят к жидкой системе. Раствор называют идеальным, если при его образовании не изменяется объём, отсутствуют тепловые эффекты, а энтропия смешения такая же, как при смешении идеальных газов. Для идеального раствора выполняется закон Рауля - парциальное давление пара компонента Рiпропорционально его мольной доле в растворе:
Рi = Рi°хi ,
где Рi° - давление пара чистого компонента при данной температуре. В идеальных растворах закон Рауля выполняется для обоих компонентов во всём диапазоне составов.
Химический потенциал компонента в идеальном растворе связан с его мольной долей соотношением
μi =μi0+RΤ lnxi .(3)
Рассмотрим равновесие идеальный жидкий раствор - насыщенный пар, который будем считать идеальный газом. При равновесии химический потенциал i-го компонента в растворе равен его химическому потенциалу в паровой фазе. Так как химический потенциал компонента в смеси идеальных газов μι = μi° + RTln Рi , то из соотношения (3) следует:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.