Поскольку целью эксплуатации является обеспечение безнакипного режима работы котла и турбины, прямоточные котлы электростанций стремятся питать водой, почти не содержащей нелетучих веществ. Питательной водой прямоточных котлов является турбинный конденсат, в который добавляют 1-2% глубоко обессоленной воды или дистиллята испарителей для восполнения потерь. На современных блочных электростанциях СКД эта смесь же после конденсатора проходит блочную обессоливающую установку (БОУ), состоящую из механических фильтров и ионообменных фильтров смешанного действия, удаляющих остатки механических (в основном окислы железа и меди) и ионных загрязнений. После БОУ электропроводность воды составляет 0,1-0,2 мкСм/см, что указывает на её высокую чистоту. Как показывает опыт, в прямоточных котлах СКД возникают главным образом железоокисные отложения преимущественно в нижней радиационной части (НРЧ), воспринимающей наиболее высокие нагрузки. Степень чистоты НРЧ и других поверхностей определяется путём осмотра контрольных образцов, вырезаемых из парогенерирующих труб, а также выборочного контроля температуры металла труб, которая увеличивается с ростом толщины отложений.
Примеры
6-1. Жёсткость питательной воды составляет 10 мкг-экв/кг. Какую концентрацию Na2CO3, г/л, необходимо создать в этой воде, чтобы при приведённом значении жёсткости выпал осадок СаСО3, если считать, что жёсткость является кальциевой и температура воды равна 298 К ?
Решение.
Произведение
растворимости ПР для карбоната кальция при 298 К равно 4,8∙10-9.
Следовательно, для образования осадка необходимо, чтобы ![]() >
> ![]() или
или ![]() >
>![]() г-ион/кг.
Это неравенство и определяет концентрацию кальцинированной соды, при которой
возможно образование осадка карбоната кальция при 298 К. Для вычисления
г-ион/кг.
Это неравенство и определяет концентрацию кальцинированной соды, при которой
возможно образование осадка карбоната кальция при 298 К. Для вычисления ![]() необходимо концентрацию иона кальция,
которая приведена в мкг-экв/кг, выразить в г-ион/л и найденное значение
подставить уже в это неравенство. Концентрацию пересчитывают по формуле
необходимо концентрацию иона кальция,
которая приведена в мкг-экв/кг, выразить в г-ион/л и найденное значение
подставить уже в это неравенство. Концентрацию пересчитывают по формуле
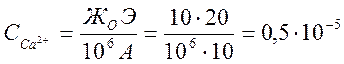 г-ион/кг,
г-ион/кг,
где ![]() -
атомная масса элемента (в данном случае кальция).
-
атомная масса элемента (в данном случае кальция).
Тогда ![]() >
>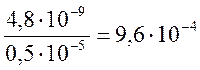 г-ион/кг.
г-ион/кг.
Поскольку Na2CO3 в растворе диссоциирует на ионы по уравнению
![]() ,
,
т.е. одной молекуле соды
соответствует в растворе один ион СО32-, то количество
молей углекислого натрия, находящихся в растворе, будет численно равно
концентрации иона СО32-, г-ион/кг. Следовательно,
концентрация Na2CO3
должна составлять: ![]() >9,6·10-4·106=0,102
г/кг,
>9,6·10-4·106=0,102
г/кг,
т.е. несколько меньше 2 мг-экв/кг.
6-2. При содержании в воде ионов Са2+, SO42- и СО32- возможно выпадение в осадок двух веществ: СаSО4 и СаСО3. Поскольку в щелочной котловой воде карбонат кальция выпадает в виде шлама, а сульфат кальция образует твёрдые накипные отложения, то на практике стремятся создать в котловой воде такие условия, чтобы в осадок выпадал карбонат, а не сульфат кальция. Этого достигают тем, что в котловой воде путём ввода кальцинированной соды поддерживают такую концентрацию иона СО32-, при которой выпадение сульфата кальция становится невозможным. Определить эту концентрацию карбонат-иона, решив задачу в общем виде.
Решение.
Для насыщенного раствора карбоната и сульфата кальция можно написать:
![]()
![]()
Выпадение сульфата кальция не произойдёт, если будет соблюдено следующее неравенство:
![]() <
<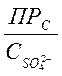 .
.
С другой стороны, для насыщенного раствора СаСО3 концентрация кальция будет равна:
![]()
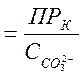 .
.
Подставляя значение ![]() в предыдущее неравенство, получаем:
в предыдущее неравенство, получаем:
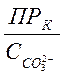 <
<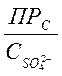 .
.
Это неравенство
определяет условие, при котором будет выпадать именно СаСО3. Решив
его относительно ![]() , найдем :
, найдем :
![]() >
>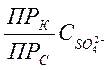 .
.
Следовательно, концентрация ионов СО32- (аналогично и ионов РО43- при фосфатном режиме) в котловой воде, при которой исключается возможность образования гипсовой накипи, зависит от концентрации сульфат-ионов. Строго говоря, предупреждающая накипеобразование концентрация ионов СО32- при введении в котёл соды или ионов РО43- при фосфатном режиме зависит и от концентрации в котловой воде других анионов, способных с ионами Са2+ образовать накипь, например ионов SiО32-.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.