 |
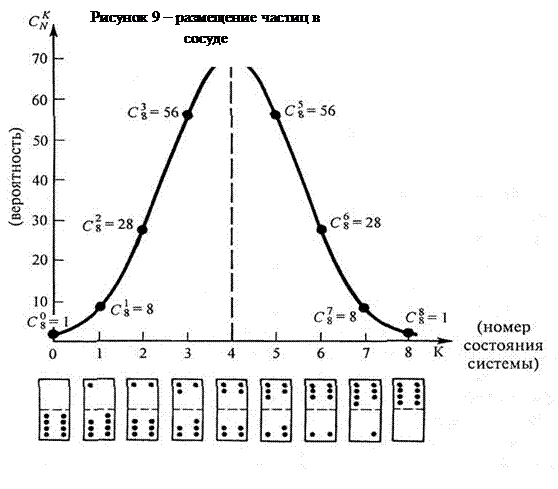
5 Аналогично объясняется необратимость процесса преобразования механической энергии во внутреннюю, например, при неупругом ударе. Кинетическая энергия тела есть мера механического процесса, а именно процесса упорядоченного переноса всех молекул в одном направлении с одной скоростью. Такое состояние может быть реализовано только одним способом. Переходу кинетической энергии, тела во внутреннюю соответствует переход от упорядоченного движения к беспорядочному. Мы не можем элементарно подсчитать число комбинаций, соответствующих различному распределению молекул по всевозможным значениям и направлениям скоростей, характеризующих беспорядочное тепловое движение. Но можно уверенно сказать, что число этих комбинаций при огромном числе молекул исключительно велико. Следовательно, вероятность реализации второго состояния значительно больше, чем первого. Итак, процесс превращения механической энергии во внутреннюю есть переход из состояния с малой вероятностью в более вероятное состояние. При огромном числе молекул этот процесс идет самопроизвольно. Обратный процесс перехода внутренней энергии в механическую означал бы переход от более вероятного состояния к менее вероятному, т. е. процесс, когда все молекулы тела одновременно начали бы двигаться в одном направлении. При большом числе молекул такой процесс столь мало вероятен, что практически никогда не происходит. Именно поэтому процесс преобразования механической энергии во внутреннюю необратим.
6 Тепловым процессам присуща определенная направленность: все они самопроизвольно протекают таким образом, что результатом является выравнивание термодинамических параметров — давления, температуры, плотности, химического состояния и т. д. Между тем из основных законов природы — законов сохранения импульса, момента импульса и энергии (в форме того начала термодинамики) — направленность и тем самым обратимость тепловых процессов никак не вытекают. В самом деле, первое начало термодинамики не накладывает запрета на процесс, при котором некоторое количество теплоты передавалось бы от холодного газа к горячему. Первое начало требует лишь одного: чтобы количество теплоты, отданное одним телом, в точности было равно количеству теплоты, которое получит другое, иными словами, чтобы полная энергия замкнутой и теплоизолированной системы не изменилась. А вот вопрос о том, от какого тела к какому перейдет энергия при теплообмене, от горячего к холодному или наоборот, остается открытым. Точно так же исходя из первого начала, нельзя объяснить необратимость процесса превращения механической энергии во внутреннюю при неупругом ударе, трении и т. п. Первое начало требует лишь одного: чтобы сумма механической и внутренней энергии замкнутой теплоизолированной системы не изменилась. Но и здесь закон сохранения энергии допускает в равной мере возможность превращения как механической энергии во внутреннюю, так и внутренней в механическую. Истинного направления процесса на основе первого начала термодинамики предсказать нельзя. Таким образом, мы приходим к выводу, что направленность и тем самым необратимость реальных тепловых процессов определяется не законами сохранения, а каким-то другим законом природы. Все рассуждения, приведенные выше, подчинены одному и тому же физическому закону. Этот закон называют вторым началом термодинамики. Существуют различные формулировки второго начала термодинамики, эквивалентные друг другу. Наиболее общая формулировка такова: В замкнутой и теплоизолированной макроскопической системе могут происходить только такие процессы, при которых система самопроизвольно переходит из состояния менее вероятного в более вероятное.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.