t=(r-ra)/v≈r/v
υ- искомая скорость
rА- радиус поверхности А ( rА≤r )
Поскольку линейная скорость поверхности В равна ωr , то
t=l/(ω×r)
l/(ω×r)=r/v
v=(ω×r2)/l
ω и rпри исполнении опыта постоянны, измерив l можно найти v.
В одном из опытов скорость поступательного движения висмута оказалась около 500м/с. В аналогичных опытах атомы серебра двигались со скоростью 600м/с. При комнатной температуре молекулы кислорода и азота движутся со скоростью 500м/с, а молекулы водорода 1600-2000м/с. Эти цифры запоминать не надо. Надо запомнить, что они имеют порядок сотен метров в секунду. Ту же скорость имеет дробь при вылете из дула охотничьего ружья.
Теоретически распределение молекул по их скоростям впервые определил в 1960г. английский физик Дж. Максвелл. ΔN - число молекул Чем выше температура, тем больше скорость передвижения молекул. Из экспериментов по определению скоростей поступательного движения и из теоретического рассмотрения этого вопроса Максвеллом были получены три важных вывода:
1 не смотря на хаотичность движения молекул, их распределение по скоростям носит характер определённой закономерности (распределение Максвелла)
2 среди молекул газа имеются как очень быстрые, так и очень медленные, но больше всего молекулы движутся с какими-то средними скоростями.
3 распределение молекул по скоростям зависит от температуры (чем больше температура, тем больше скорость)
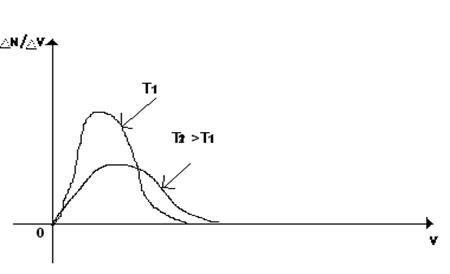
Рисунок 2– График зависимости V от ΔM/ΔV
Число, масса и размеры молекул.
Реальные молекулы имеют сложную форму, и следовательно различные размеры по разным направлениям. Если для простоты принять, что молекула имеет форму шара, то речь будет идти о её диаметре, который можно определить, используя свойство маслянистых веществ растекаться по поверхности жидкости. Растёк по поверхности образует очень тонкую плёнку, толщина которой приблизительно равна d молекул вещества. Основная трудность этого способа заключается в том, чтобы взять очень мало маслянистого вещества. В противном случае оно покроет всю поверхность воды в несколько слоёв молекул. Поэтому для опыта берут маслянистую жидкость, разведенную в каком-нибудь летучем веществе, например, в спирте. Пятно обычно имеет форму почти правильного круга
S=πd2/4
Разделив объём на площадь, узнаем толщину слоя или приблизительно диаметр молекулы. На практике измерять массы молекул и атомов в килограммах и граммах оказалось неудобным.
Новые единицы
Атомной единицей массы называется 1/12 масса изотопа углерода С12. Изотопами называются атомы одного и того же химического элемента отличающегося только своей массой. Масса молекулы (атома ), выраженная в атомных единицах массы, называется относительной молекулярной (атомной) массой.
Она показывает во сколько раз масса молекулы вещества больше 1/12 изотопа углерода С12.
Атомная единица массы составляет 1,660×10-27кг.
Масса молекулы в килограммах m=mотн×1,660×10-27 кг
Mотн.Н=2,01594 водород
Mотн.N=28,0134 азот
Очень удобно пользоваться такими порциями газа, в которых содержится одинаковое количество молекул. Молем (грамм-молекулой) называется количество вещества, масса которого в граммах равна его относительной молекулярной массе.
Часто пользуются понятием киломоля 1киломоль=1000 молей
Количество молекул в одном киломоле вещества называется числом Авогадро и обозначается NA. Один киломоль газа при нормальных условиях имеет объём 22,4 м3
Закон Авогадро: В равных объёмах различных газов при одинаковом давлении и температуре содержится одинаковое число молекул.
Число молекул газа в единице объёма при нормальных условиях называется числом Лошмидта и обозначается nл .
Осмысление и систематизация знаний
|
Основные положения молекулярно-кинетической теории |
Опытные обоснования |
Количественные характеристики |
|
1 Все вещества состоят из огромного числа весьма маленьких частиц – молекул, между которыми имеются межмолекулярные промежутки. 2 Молекулы находятся в непрерывном хаотическом движении. 3 Между молекулами существуют силы притяжения и отталкивания. |
Броуновское движение (опыт Перрена). Опыт Штерна. Опыт по изменению числа молекул. Опыт по изучению диффузий. |
Размеры молекул, масса молекул, скорость движения, длина свободного пробега. |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.