Объединенный газовый закон:
P=n0×k×T
n0 – число молекул в единице объема газа
n0=N/V
N – общее число молекул
V – объем газа
(P×V)/T=N×k где N и k const при m const.
(P×V)/T=const
При постоянной массе газа произведение объема на давление, деленное на абсолютную температуру газа, есть величина, одинаковая для всех состояний этой массы газа.
P1, V1, T1 – значение в начале процесса
P2, V2, T2 – значение в конце процесса
(P1×V1)/T1=( P2×V2)/T2
Уравнение Клапейрона - Менделеева. Плотность газа
Выясним, какой вид будет иметь соотношение, если в него ввести молярную газовую постоянную R. Так как N-полное число молекул в массе газа m, а NA -число молекул в одном моле, то
N=ν×NA
Где ν -число молей в массе газа m. Поэтому pV/T=ν NA×k
Поскольку NA×k =R, а ν равно массе газа m, деленной на массу одного моля газа u, то получаем
pV/T=(m/μ)R (1)
Соотношение (1) называется уравнением Клапейрона - Менделеева или уравнением состояния для произвольной массы идеального газа. Для одного моля идеального газа уравнение Клапейрона - Менделеева принимает вид
pVмоль=RT (2)
С помощью формулы (1) легко выяснить, какими величинами определяется плотность газа. Так как ρ=m/V, то из (1) имеем
P= ρμ/RT (3)
Зависимость средней квадратичной скорости молекул газа от температуры.
Выясним теперь, как можно с
помощью вычислений находить среднюю квадратичную скорость движения молекул
газа. Поскольку средняя кинетическая энергия поступательного движения молекул
газа E=(3/2)kT, то можно написать mvс.к.2/2=(3/2)kT, откуда
![]() . Отметим, что под m
в формуле подразумевается масса одной молекулы в килограммах. Так как k=R/Na, получим
. Отметим, что под m
в формуле подразумевается масса одной молекулы в килограммах. Так как k=R/Na, получим ![]() vс.к.. Поскольку mNA есть масса одного моля газа μ, имеем
vс.к.. Поскольку mNA есть масса одного моля газа μ, имеем ![]() .
.
Наконец, из (3) следует, что RT/μ=p/ρ, поэтому
![]()
Среднюю квадратичную
скорость можно находить по любой из формул. Из функции Максвелла можно получить
формулы для средней арифметической скорости и наивероятнейшей скорости. Средняя
арифметическая скорость ϋ=![]() .
.
Изобарический процесс
 Процессы,
при которых масса газа и один из его параметров остаются постоянными,
называются изопроцессами (от греческого «изос» - равный, одинаковый). Поскольку
имеются три параметра газа, существуют три различных изопроцесса. Первый из них
изохорический. На рисунке 1 схематически изображен опыт Гей-Люссака. Колба с
газом помещается в сосуд с водой и льдом. В пробку вставлена трубка, изогнутая
таким образом, что свободный конец ее горизонтален. Газ в колбе отделен от
окружающего воздуха небольшим столбиком ртути в трубке. Температуру газа
определяют по термометру, а объем - по положению столбика ртути. Для этого на
трубке нанесены деления, соответствующие определенному внутреннему объему
трубки (при градуировке трубки можно учесть и расширение сосуда при нагревании,
но оно сравнительно мало).
Процессы,
при которых масса газа и один из его параметров остаются постоянными,
называются изопроцессами (от греческого «изос» - равный, одинаковый). Поскольку
имеются три параметра газа, существуют три различных изопроцесса. Первый из них
изохорический. На рисунке 1 схематически изображен опыт Гей-Люссака. Колба с
газом помещается в сосуд с водой и льдом. В пробку вставлена трубка, изогнутая
таким образом, что свободный конец ее горизонтален. Газ в колбе отделен от
окружающего воздуха небольшим столбиком ртути в трубке. Температуру газа
определяют по термометру, а объем - по положению столбика ртути. Для этого на
трубке нанесены деления, соответствующие определенному внутреннему объему
трубки (при градуировке трубки можно учесть и расширение сосуда при нагревании,
но оно сравнительно мало).
Сначала по положению столбика ртути l определяют V0 - объем газа при 0ºС. Затем газ нагревают (столбик ртути перемещается в положение 2), в процессе нагревания записывают значение объема и температуры и строят график, который называют изобарой.
Оказывается, что изобара представляет собой прямую линию, которая пересекается с осью абсцисс в точке А.
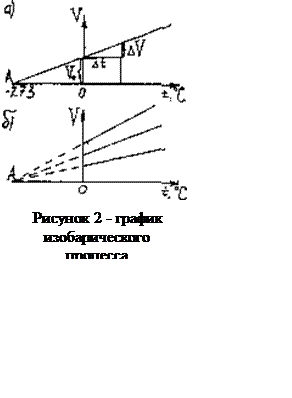 Из
подобия треугольников на рисунке 2 следует
Из
подобия треугольников на рисунке 2 следует
V0/OA=ΔV/Δt,
или
1/ OA=Δ/(V0Δt).
Обозначив 1/ОА через β, получим:
ΔV=β V0 Δt
Здесь β - температурный коэффициент объемного расширения газа.
Если повторять этот опыт для разных газов или для разных масс газа, то все графики будут пересекаться в точке А, соответствующей
t=-273ºС, т.е. коэффициент β=1/AO=(1/273)ºC-1 одинаков для всех газов. Это означает, что расширение газа при изобарическом процессе не зависит от его природы. Процесс в газе, который происходит при постоянной массе и неизменном давлении, называется изобарическим (от греческого «барос» - тяжесть). Этот процесс был изучен французским учёным Л.Гей – Люссаком 1802г.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.